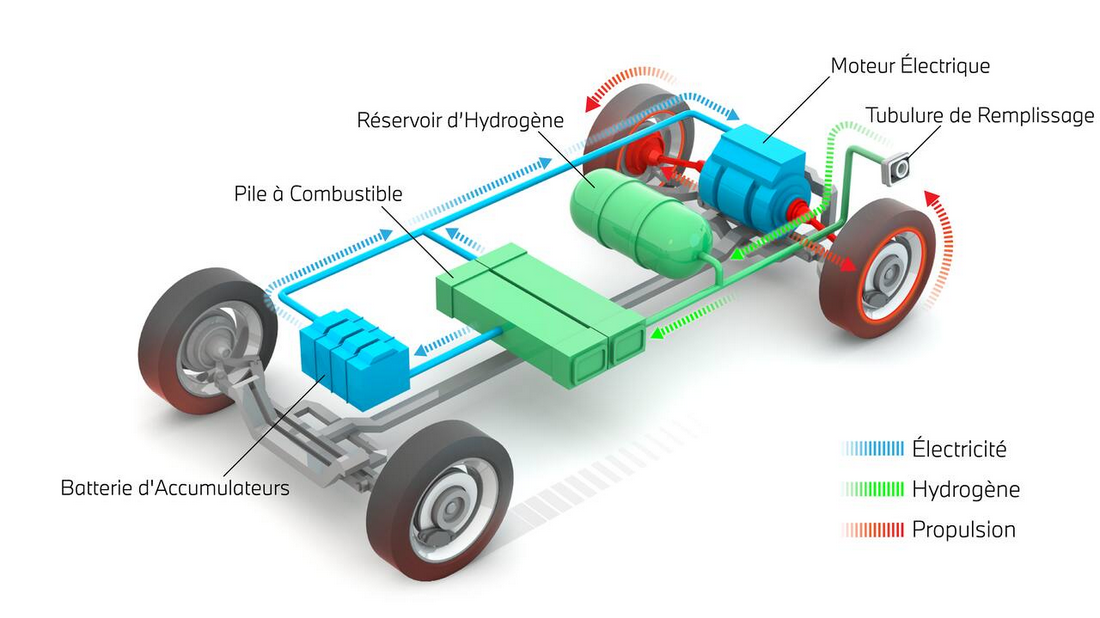
L'électricité , les Piles Batteries
Accumulateurs
L'électricité
Le mot électricité désigne un ensemble de phénomènes
créés par le déplacement de particules élémentaires
et se manifestant sous forme calorifique, chimique, lumineuse, magnétique
ou mécanique, dont les manifestations naturelles sont la foudre
et la capacité d'attraction/répulsion qu'ont certains
matériaux préalablement frottés.
Il y a 2600 ans, Thalès est parvenu à attirer des brins
de pailles à l’aide d’ambre, une pierre, dont le nom
grec est « elektron », qui a donné son nom
à l’électricité.
En 1672, l'Allemand Otto von Guericke construisit un générateur
primitif à friction : une boule de soufre tournant à grande
vitesse sur un axe. Quand Guericke a posé sa main sur la boule
et a tourné l'axe rapidement, une charge d'électricité
statique s'est accumulée. C'est la première d'une longue
série de machines qui vont servir aux scientifiques étudiant
l'électricité, et à l'amusement du grand public
grâce aux effets électrostatiques parfois spectaculaires
présentés.
Dans les années 1720, l'anglais Stephen Gray établit expérimentalement
que l'électricité peut être transmise par certains
matériaux et ne l'est pas par d'autres : c'est le début
de la notion de matériaux conducteurs et isolants. Il constate
aussi qu'un corps électrisé peut en électriser
un autre qui lui est proche . Poursuivant les travaux de Gray, le français
Charles-Antoine Dufay constate que deux corps électrisés
peuvent soit s'attirer, soit se repousser, ce qui le conduit à
émettre l'hypothèse de l'existence de deux sortes d'électricité
statique : l'électricité « vitrée »,
obtenue en frottant verre, pierres ou fourrure, et l'électricité
« résineuse », obtenue en frottant ambre, résine
ou soie. Il formule la théorie selon laquelle deux corps contenant
la même électricité se repoussent, alors que deux
corps contenant de l'électricité de nature différente
s'attirent. Ses travaux, publiés dans plusieurs Mémoires
adressés à l'Académie royale des Sciences à
partir de 1733, relancent la polémique entre scientifiques sur
la nature de l'électricité, qui durera jusqu'à
la fin du siècle.
En 1745, l'Allemand, Ewald von Kleist, trouva une méthode
pour stocker cette charge dans une bouteille en verre remplie à
moitié d'eau et refermée à l'aide d'un bouchon
de liège. Il stocka l'électricité dans l'eau par
l'intermédiaire d'un clou inséré dans le liège
et touchant le fluide, le clou étant chargé à l'aide
d'un générateur à friction. Alors qu'il tenait
la bouteille d'une main, il reçut une puissante décharge
lorsqu'il toucha le clou avec son autre main. Kleist se convainquit
qu'une charge substantielle pourrait être accumulée lorsqu'il
reçut ce choc électrique significatif.
Cette invention est restée sous le nom de « bouteille
de Leyde » parce qu'en 1746, Pieter van Musschenbroek, professeur
de l'université de Leyde, fit indépendamment la même
découverte et la fit connaître au monde scientifique. Musschenbroek
décrit ainsi son expérience dans une lettre du 20 avril
1746, adressée à Réaumur :
« Dans ce but, j'avais suspendu à deux fils de soie
bleue (toujours de la soie bleue) un canon de fer, qui par communication
recevait l'électricité d'un globe de verre qu'on faisait
tourner rapidement sur son axe, pendant qu'on le frottait en y appliquant
les mains. À l'autre extrémité pendait librement
un fil de laiton dont le bout était plongé dans un vase
de verre rond, en partie plein d'eau, que je tenais dans ma mains droite
; avec l'autre main, j'essayais de tirer des étincelles du canon
de fer électrisé. Tout à coup ma main droite fut
frappée avec tant de violence, que j'eus tout le corps ébranlé
comme d'un coup de foudre. »
Daniel Gralath combina le premier plusieurs bouteilles en parallèle
dans une « batterie » de capacité totale supérieure
à celle d'une seule bouteille.
En 1756, le philosophe allemand Æpinus fabrique
sur le même principe le condensateur plan qui porte son nom, le
diélectrique est maintenant l'air compris entre deux plaques
de métal que l'on peut rapprocher ou éloigner pour changer
la capacité de celui-ci.
La première application de cette invention était
de donner des commotions (chocs électriques ou électrisations)
au public dans les foires. Par exemple, à Versailles, on présenta
au roi Louis XV l'expérience de la décharge d'une grosse
bouteille de Leyde à travers le circuit formé de plus
de deux cents courtisans.
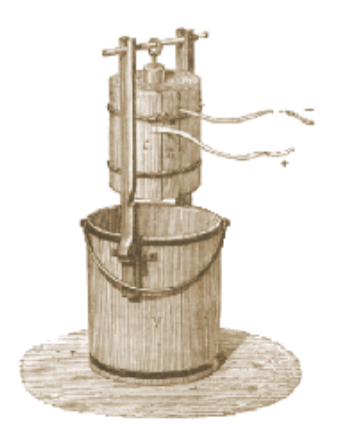
La bouteille de Leyde est un condensateur formé de deux conducteurs
séparés par le verre de la bouteille. Le premier conducteur
est généralement constitué d'une électrode
supérieure, reliée par une petite chaîne à
des feuilles en étain chiffonnées contenues dans la bouteille.
Le second conducteur est formé par une feuille métallique
enveloppant la bouteille. Les faces intérieure et extérieure
stockent une charge électrique égale mais de signe opposé.
La bouteille originale était constituée d'une bouteille
en verre recouverte d'une feuille de métal et contenant accidentellement
de l'eau impure agissant comme un conducteur, reliée par une
chaine à une sphère métallique. L'hypothèse
initiale était que le courant électrique était
analogue au courant de l'eau et donc que l'électricité
pouvait être stockée dans l'eau. On a découvert
ensuite que les charges s'accumulent sur les surfaces en vis-à-vis,
séparées par le verre formant un diélectrique,
et que le liquide pouvait être remplacé par des feuilles
métalliques reliées à l'électrode par une
tige conductrice. Les charges sont stockées à la surface
des éléments, à la frontière avec le diélectrique.
Plus le diélectrique est fin et donc plus l'espace entre les
plaques est mince, plus la charge cumulable à une tension donnée
est importante.
En 1768, la « machine de Ramsden » voit le jour, elle permet
de créer de l’électricité statique en actionnant
une manivelle.
...
Avant de revisiter la version officielle de l’histoire des inventions scientifiques, il existe, depuis plus de quatre-vingts ans, une histoire parallèle qui est censée remonter la date de l’invention de la pile électrique à il y a près de deux mille ans ! Cette histoire parallèle est anonyme et n’a pas de fondement « historique », mais une origine archéologique.
La pile électrique des Parthes
En 1936, des archéologues européens ont mené des
fouilles dans des ruines antiques datant approximativement du début
de notre ère, sur une colline située près de Khujut
Rabu, un village qui se trouve au sud-est de Bagdad, et où se
situait autrefois la ville de Ctésiphon, ancienne capitale de
la dynastie parthe des Arsacides (247 av. J.-C.-224 apr. J.-C.), puis
de la dynastie perse des Sassanides (224-651 apr. J.-C.).
Ctésiphon fut construite par les Arsacides face
à Séleucie du Tigre, ancienne capitale des Séleucides.
La ville parthe s’étendait sur 30 km². Ctésiphon
fut longtemps la résidence d’hiver des rois arsacides. Plus
tard, la ville devint l’une des capitales de la dynastie des Sassanides.
Dès 317 de notre ère, Ctésiphon fut le siège
principal de l’Église de l’Orient. En 637, la capitale
sassanide fut envahie par les troupes arabes musulmanes pendant la conquête
de la Perse. En 762, les Arabes commencèrent à utiliser
les matériaux de Ctésiphon pour construire Bagdad, bâtie
à quelques kilomètres de la ville antique.
Lors des fouilles de 1936 à Khujut Rabu, les archéologues
découvrirent de nombreux objets dont un vase qui les laissa perplexes
sur son usage antique. Ces objets furent transférés aux
caves du Musée archéologique de Bagdad où travaillait
l’Autrichien Wilhelm König.
Wilhelm König se rendit en Irak en 1930 pour accompagner
une mission archéologique de la Deutsche Orient-Gesellschaft
(DOG, Société allemande d’Orient). Il travailla pendant
un an pour le compte de la DOG sur le site d’Uruk, cité
de l’ancienne Mésopotamie dans le sud de l’Irak. En
1931, König s’installa à Bagdad et accepta un poste
d’assistant technique au Musée archéologique de Bagdad
(aujourd’hui, Musée national irakien). Wilhelm König
occupa ce poste jusqu’en février 1939 avant son retour à
Vienne suite à une infection sanguine. Dès son retour
en Autriche, König publia un livre intitulé « Im verlorenen
Paradies, Neun Jahre Irak » dans lequel il raconte son séjour
irakien.


Le Tâq-e Kasrâ, un palais sassanide, à 35 km au sud-est
de Bagdad, est le seul vestige visible de Ctésiphon.
En 1936, König se mit à étudier les objets découverts
à Khujut Rabu et s’intéressa particulièrement
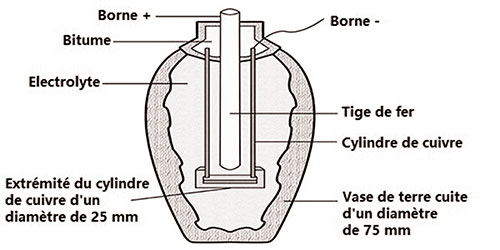
au vase « mystérieux ». Il s’agissait d’un
petit vase de terre cuite de 15 centimètres de hauteur sur environ
7,5 centimètres de diamètre. Le vase lui-même n’avait
rien d’étrange, c’était son contenu qui le rendait
énigmatique. Il était fermé initialement avec un
bouchon en bitume. Sous le bouchon se trouvait une tige de fer insérée
à l’intérieur d’un cylindre de cuivre. Les deux
éléments métalliques avaient été
isolés soigneusement l’un de l’autre à la base
du vase par un tampon en bitume. D’ailleurs, le cylindre de cuivre
était soudé en son fond par un alliage de plomb et d’étain.
Ce dispositif était familier à König et aux archéologues
qui avaient découvert l’objet. Ce vase de la dimension d’une
lampe de poche ordinaire ne semblait pas pouvoir être autre chose
qu’une pile électrique ! N’y manquaient qu’un
acide (électrolyte) et un fil conducteur allant du cylindre de
cuivre à l’extérieur (et qui s’était
peut-être décomposé au cours des siècles
?).
D’après König, l’ensemble trouvé dans chaque
vase pouvait constituer une pile électrique dont il reconstitua
le schéma . « Il suffit pour la compléter de verser
une solution saline ou acide dans le tube de cuivre. », écrit-il
en 1938.


Schéma de la pile de Bagdad, présenté par Wilhelm
König.
Au grand étonnement de König, le vase n’était
pas un objet isolé. Les archéologues en avaient découvert
quelques-uns à Khujut Rabu et une dizaine d’autres sur le
site de Ctésiphon.
Wilhelm König pensait que ces poteries étranges dataient
de l’époque de l’Empire parthe des Arsacides. Mais
plus tard, le docteur St John Simpson du département du Proche-Orient
antique du British Museum a estimé que le vase daterait plutôt
du début de l’ère des Sassanides.
En tout état de cause, dès le début,
Wilhelm König fut convaincu qu’il s’agissait d’une
pile électrique.
Mais comment expliquer l’invention et surtout l’usage d’une
batterie électrique qu’on peut dater de la période
parthe, entre le Ier siècle avant et le Ier siècle après
J.-C.? Admettons, pour le moment, qu’il s’agirait vraiment
d’une pile produisant un faible courant électrique : à
quoi cela pouvait-il servir ? Pour présenter sa découverte,
König publia en 1936 un court article de deux pages dans la revue
scientifique « Forschungen und Fortschritte » intitulé
« Un élément galvanique de la période parthe
? »
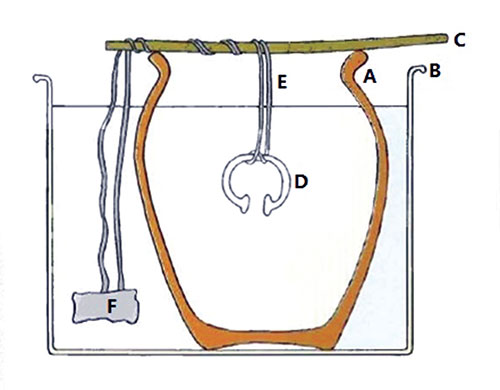
Dispositif des orfèvres de Bagdad au début du XXe siècle
pour dorer les petits objets métalliques.
A : poterie poreuse contenant une solution de cyanure d’or
B : récipient contenant de l’eau salée à l’extérieur
de la poterie
C : tige soutenant le fil métallique de conduction
D : objet à dorer
E : fil métallique
F : morceau de zinc
Pour appuyer son hypothèse, Wilhelm König
se référa à une technique élémentaire
de galvanisation utilisée vers le début du XXe siècle
par les orfèvres de Bagdad pour dorer les bijoux. Il avait vu
les orfèvres de Bagdad utiliser une pile rudimentaire grâce
à laquelle il se produisait une réaction électrochimique
dorant les petits objets métalliques. L’archéologue
autrichien croyait que cette technique pouvait être issue d’un
dispositif plus ancien : la pile électrique des Parthes (Figure
ci dessus).
Mais la « pile de Bagdad » fonctionne-t-elle réellement
? Des chercheurs ou des centres scientifiques ont testé de nombreuses
fois ces objets archéologiques en tant que pile électrique
en procédant avec des répliques exactes des « piles
électriques » des Parthes.
En 1939, Willy Ley, ingénieur et vulgarisateur
scientifique américain d’origine allemande, popularise l’idée
de König dans une revue de science-fiction. Un an plus tard, l’Américain
Willard Gray, ingénieur au laboratoire de General Electric à
Pittsfield (Massachusetts), lit la théorie de König. À
l’aide de dessins et de détails fournis par Willy Ley, Gray
créé une reproduction fidèle de l’objet antique.
En utilisant une solution de sulfate de cuivre, il réussit à
générer près de 0,5 volt d’électricité.
Après cette expérience, le vulgarisateur Willy Ley dit
qu’il était convaincu qu’« à l’époque
de Jésus Christ, les Parthes avaient des piles électriques
à Ctésiphon ».
En 1978, l’égyptologue allemand Arne Eggebrecht fabriqua
une réplique de la pile de Bagdad et la remplit de jus de raisin
fraîchement pressé, en estimant que l’acide acétique
ou l’acide citrique comme électrolyte étaient aisément
disponibles à l’époque antique. Sa réplique
généra 0,87 V d’électricité. Il utilisa
ensuite le courant de la batterie pour galvaniser une statuette en argent
avec de l’or. Différents spécialistes ont reproduit
la pile en utilisant du jus de raisin comme électrolyte et ont
effectivement obtenu un courant électrique, suivant les expérimentateurs,
entre 0,5 et 1,5 volt.
Les piles électriques de Bagdad deviennent de plus en plus populaires
dans les années 2000.
En 2005, les équipes de « MythBusters », une émission
télévisée de Discovery Channel, reproduisent l’expérience
de dorure sous les yeux des téléspectateurs et disent
que l’hypothèse de la pile de Bagdad est « plausible
».
Ces expériences suffisent-elles pour prouver que les batteries
électriques ont été inventées et utilisées
environ 1800 ans avant leur invention moderne par Alessandro Volta en
1799 ? On imagine que ces « piles électriques » étaient
utilisées dans l’Antiquité pour galvaniser de l’or
sur des objets métalliques, mais jusqu’à présent
cette affirmation n’a pas été prouvée concrètement.
La communauté scientifique reste très
dubitative quant à l’hypothèse de l’invention
et de l’usage des piles électriques à Ctésiphon
à l’époque des Arsacides, il y a 2000 ans. Les historiens
des sciences mettent également en doute que cette « pile
» ait été utilisée pour la dorure d’objets
métalliques.

Les doutes exprimés par les savants se fondent sur une question
de « méthode scientifique ». Autrement dit, ils mettent
en doute le fondement scientifique et même historique de l’invention
et de l’usage des piles électriques à l’époque
des Parthes. Bien que les vases découverts à Khujut Rabu
et Ctésiphon puissent servir de « pile électrique
voltaïque », ils insistent à dire que certains éléments
(dont les fils conducteurs) manquent à cet ensemble. En outre,
la dorure d’objets métalliques par électrolyse supposerait,
selon les savants, que dans l’Antiquité, les gens auraient
eu accès à des sels d’or en solution, ce qui serait
très peu vraisemblable, car ces derniers ne furent connus que
beaucoup plus tard pendant le Moyen-Âge. Le procédé
des orfèvres de Bagdad que König mentionne dans son article
de 1936 suppose l’usage de sels d’or en solution. Or, dans
l’Antiquité l’usage de tels sels est très hypothétique,
selon les historiens des sciences. L’or est un « métal
noble » qui résiste à la corrosion et à l’oxydation.
L’or ne s’oxyde pas et on le trouve dans la nature uniquement
à l’état métallique, car l’or n’est
pas soluble dans les solutions basiques ou les acides forts, à
l’exception de l’eau régale.
Avant les progrès de l’alchimie médiévale,
dus essentiellement aux méthodes expérimentales des savants
musulmans, on ne connaît pas, selon les historiens des sciences,
de méthode permettant par une réaction chimique de «
dissoudre » l’or pour obtenir des sels d’or solubles.
Les Parthes n’avaient-ils réellement pas la possibilité
d’avoir accès au sel d’or soluble ? Pour répondre
à cette question, le chimiste Emmerich Paszthory publia un article
en 1989 pour montrer qu’il était théoriquement possible
d’obtenir, il y a 2000 ans, des sels d’or en solution. Dans
cet article, Paszthory explique que si on écrase des amandes
amères ou des noyaux de cerises aigres avec un peu de levure
de bière, de l’eau et de la poudre d’or, on pourra
obtenir, avec de la chaleur et du temps, une « très bonne
solution électrolytique de sel d’or » !
Cet exemple explique très clairement l’argument principal de la communauté scientifique qui rejette l’idée de l’invention et de l’usage des piles électriques à l’époque des Parthes à Ctésiphon en mettant en mettant en question la « méthode de recherche ». Les savants disent qu’il ne suffit pas que les archéologues se fondent sur nos connaissances actuelles pour montrer qu’une technique ancienne aurait été possible pour en conclure ensuite qu’ellea effectivement été appliquée.
1800 La pile Volta
Le physicien italien Alessandro Volta (1745-1827)
s’intéresse de près aux expériences menées
par Luigi Galvani en 1786. Luigi Galvani testait la machine de
Ramsden, une machine conçue vers 1768, pour générer
des étincelles mécaniquement à l’aide d’une
manivelle, et sur les cadavres de grenouilles. Cette machine produisait
des petits sursauts au niveau des muscles des cadavres.
C’est en 1799, que Volta pour trancher une controverse qui
l’oppose au physicien Luigi Galvani, qu’il réalise
une expérience qui montre que le contact entre deux matériaux
différents, reliés par un conducteur, permet de fabriquer
de l’électricité. Volta découvrit qu'un flux
continu de force électrique était possible lorsqu'on utilisait
certains fluides conducteurs pour engendrer une réaction chimique
entre des métaux. De plus Volta s'aperçut que la tension
augmentait lorsque les piles voltaïques étaient empilées.
Ceci conduisit à l'invention de la batterie.
Pour la petite histoire : Bonaparte et Volta
Robertson (né à Liège) était le premier
expérimentateur du galvanisme en France, il s’était
intéressé très tôt aux expériences
de Galvani à Bologne, en 1789. Il avait été impressionné
par ces dernières au cours desquelles, ce qui sera identifié
comme un courant galvanique, animait les nerfs et les muscles de grenouilles
mortes. Il s’en explique dans ses Mémoires : Un paragraphe
d’un journal italien me révéla les premiers phénomènes
observés par Galvani et répétés par Volta.
J’essayai aussitôt de les reproduire ; et jugeant qu’ils
étaient de nature à piquer la curiosité… et
à étendre la science, je n’hésitai pas à
les rendre publics. Ils firent en effet beaucoup d’impression.
Ses premières expériences galvaniques auront lieu au Pavillon
de l’Échiquier, dès l’an VI. En 1800, il reprendra
les expériences que Volta avait réalisées à
la Société Royale de Londres. Aussi, lorsque ce dernier
vint à Paris, en 1801, pour y démontrer la véritable
théorie du galvanisme, celle-ci y était déjà
connue grâce à Robertson et à plusieurs appareils
nouveaux dont il était l’auteur, tel un galvanomètre,
le premier imaginé en France dont il avait donné la description
dans un mémoire lu à l’Institut, le 8 fructidor an
VIII (26 août 1800), et dont il détaille la constitution
et le fonctionnement dans le tome premier de ses Mémoires13.
Ce fut lui qui, dans des séances à l’Institut, les
16,18 et 21 brumaire an X (7, 9 et 12 novembre 1801), et devant Bonaparte,
alors premier Consul, leva tous les doutes de l’identité
du galvanisme avec l’électricité, en enflammant le
gaz hydrogène avec l’étincelle galvanique. Il se
présentera dans ses Mémoires comme un membre de la Société
galvanique de Paris. Robertson apparait ici, sinon comme un inventeur,
tout au moins comme un vulgarisateur préoccupé de diffuser
dans le public les découvertes récentes en matière
d’électricité.
Ces expériences de galvanisme associées à d’autres
démonstrations de procédés électriques,
comme l’usage spectaculaire du pistolet de Volta qui éclatait
au contact d’un chat dont les longs poils se chargeaient d’électricité,
se déroulaient, le plus souvent, en préambules des séances
de fantasmagorie...
La période au cours de laquelle Volta effectua
les travaux qui conduisirent finalement à la mise au point de
la pile fut loin d'être sereine en Europe occidentale, en Italie
notamment.
Napoléon Bonaparte commence le 12 avril 1796, à l'extrémité
méridionale des Alpes, au col de Cadibone entre Nice et Gênes,
la première campagne dite « d'Italie » qui se termina
le 18 avril 1797 à Leoben, à l'extrémité
orientale des Alpes : 18 batailles, 65 combats pour vaincre cinq armées
autrichiennes sur le sol de l'Italie du nord. Le 15 mai 1796, Napoléon
Bonaparte faisait une entrée triomphale dans Milan. Volta y assista
en tant que représentant des patriciens de Côme. Ce fut
sans doute la première fois qu'il voyait Napoléon. Le
17 octobre 1797, le traité de Campo-Formio préparait une
large réorganisation de l'Italie du nord, avec la création
en particulier de la République Cisalpine formée du Milanais,
du duché de Modène et de la Romagne enlevée au
pape. Volta devint ainsi citoyen de la République Cisalpine et
à ce titre, comme tout autre citoyen en âge de porter les
armes, il fut requis pour monter la garde avec la Legione Pavese en
mai 1798. Cet événement se place donc à un moment
particulièrement crucial pour Volta, alors qu'il allait tout
juste mettre au point la pile ; on peut supposer que les préoccupations
de Volta devaient être alors assez éloignées des
soucis posés par un simple tour de garde. La même année,
dans le courant du mois de décembre, le célèbre
anatomiste bolonais, Luigi Galvani, dont Volta avait combattu la théorie
de l'électricité dite « animale », beaucoup
moins chanceux que lui, mourait dans la misère, après
avoir été expulsé de l'Université de Bologne
pour avoir refusé de jurer fidélité à la
République Cisalpine, ceci afin de rester en accord avec ses
principes religieux et sa fidélité au pape. Dans les mois
qui suivirent, la situation politique en Italie se dégrada à
nouveau. Avec la formation de la seconde coalition, les combats reprirent,
entraînant la perte en 1799 pour le Directoire de toute l'Italie
hormis Gênes. La campagne de 1800 permit la reconquête de
l'Italie du nord au prix évidemment de nouveaux combats et le
rétablissement de la République Cisalpine, qui fut confirmé
lors du traité de Lunéville, le 9 février 1801.
On voit donc que la découverte de la pile et la publication des
résultats s'y rapportant, notamment la lettre à sir Joseph
Banks, survinrent sur fond de combats et d'instabilité politique,
en particulier dans le pays de son découvreur, Volta, dont le
laboratoire de Pavie fut même endommagé par des boulets
(français)...
Pendant les années qui précédèrent la découverte de la pile, Volta jouissait déjà d'une grande notoriété dans les milieux scientifiques. Ainsi, une lettre du 18 juillet 1791 de Charles Peter Layard lui apprenait qu'il venait d'être élu membre, à titre étranger, de la Royal Society, et en 1794, cette même institution lui décernait une médaille d'or (la médaille dite « de Copley » – une sorte de prix Nobel de l'époque).
Ni Bonaparte, ni Monge d’ailleurs, ne semblaient
se douter qu’à Pavie, ils sont passés à côté
d’un grand savant et des prémices d’une grande découverte.
Volta, alors professeur de physique de l’Université
est en discussions passionnées avec le professeur de Bologne
Galvani, à propos du galvanisme, de l’électricité
animale, de l’électricité des métaux. Volta
est déjà crédité de deux découvertes
importantes : l’électrophore (1775) et le condensateur,
qui permettent de transporter et d’accumuler des charges électriques.
Dans une lettre datée de 1797, il parle même « du
galvanisme ou de l’électricité produite par le contact
de conducteurs différents ». Aussi, plusieurs auteurs se
sont demandés pourquoi Volta n’avait réalisé
sa pile qu’en 1799. Deux raisons ont été avancées
: d’ordre familial (il s’est marié en 1794 et a eu
rapidement plusieurs enfants) et politique, car la situation est alors
très troublée en Lombardie, possession autrichienne jusqu’en
1796, passée sous influence française après le
traité de Campo-Formio et la création d’une «
République cisalpine ». Bonaparte, parti en Égypte
au printemps 1798, les hostilités reprennent, Moreau est battu
à Cassano en avril 1799 et la Lombardie repasse sous domination
autrichienne. L’Université de Pavie est fermée, en
raison de son attitude « collaborationniste » avec les Français,
mais Volta, qui a gardé ses distances avec l’occupant, n’est
pas inquiété. L’intermède autrichien va durer
13 mois, jusqu’en mai 1800. C’est au cours de cette période
que Volta, probablement fin 1799, découvre son « organe
électrique artificiel », qui sera appelé «
pile » du fait de sa première configuration en colonne.
Ce système électrochimique empile alternativement des
couches de métaux différents (cuivre ou zinc et argent),
séparées par des feutres imbibés d'acide (électrolyte).
Volta conçoit ainsi une colonne, 'pila' en latin, constituée
de plusieurs couples de disques de zinc et de cuivre, séparés
par un tissu imbibé d’eau salée ou d’acide sulfurique.
La toute première pile comporte environ 600 disques et mesure
presque 1,5 m. Un fil métallique relie les deux extrémités
: le zinc se charge de fluide positif, et le cuivre, de tension négative,
créant un fort courant électrique.



Cette invention prodigieuse était cependant composée d’éléments
assez simples : un récipient, des disques de deux métaux
différents (cuivre et zinc) et de la saumure d’une solution
aqueuse de sel (NaCl) qui servait d’électrolyte, c’est-à-dire
une substance conductrice, car elle contient des ions mobiles.
Cette découverte, abondamment décrite par Louis Figuier,
est annoncée officiellement par Volta dans une lettre de mars
1800 adressée de Côme à Joseph Banks président
de la Société Royale de Londres, dont Volta est membre
à titre étranger. Volta y décrit sa colonne de
couples zinc-cuivre séparés par des cartons imbibés
d’« humeur » (eau salée, lessive). Une partie
de la lettre parvient à Londres début avril. Banks en
fait part à quelques membres de la Société. Le
30 avril, le chirurgien Carlisle construit son « appareil électromoteur
» d’après la description de Volta, et réalise
diverses expériences dont, avec le physicien Nicholson, la décomposition
de l’eau par le courant électrique. La fin de la lettre
ne parvient à Londres qu’à la mi-juin et Banks donne
connaissance de la totalité de la lettre lors d’une séance
de la Société Royale. En juillet 1800, le Journal philosophique
de Nicholson reproduit la lettre de Volta et rapporte une série
d’expériences déjà réalisées
par les Britanniques .
La situation politique s’est dégradée à
Paris depuis le départ de Bonaparte en Égypte. Il rentre
précipitamment en France et le coup d’État du 18
Brumaire an VIII (9-10 novembre 1799) porte Bonaparte au Consulat, d’abord
comme Consul provisoire, puis Premier Consul par la Constitution de
l’an VIII (décembre 1799). Bonaparte engage la seconde campagne
d’Italie en mai 1800, le 6 juin il s’empare de Milan, le 10,
c’est la victoire de Marengo qui marque la reconstitution de la
république cisalpine. L’Université de Pavie est ouverte
à nouveau, Volta y reprend ses cours et prête, cette fois,
serment de fidélité à la nouvelle république.
Volta propose (de sa propre initiative, ou suite à des sollicitations
?) d’aller à Paris, avec un de ses collègues, le
professeur de chimie Brunatelli, pour exprimer la reconnaissance de
l’Université au Premier Consul. Volta souhaite aussi faire
connaître son invention aux savants français et recevoir
leur consécration. Mais les hostilités ne sont pas terminées,
la guerre de la deuxième coalition ne prendra fin qu’avec
la victoire de Hohenlinden (décembre 1800) et la signature du
traité de Lunéville (février 1801). Si bien que
le voyage de Volta, d’abord envisagé pour septembre 1800
est reporté d’un an. La mission politique « d’alliance
du talent et de la science pour l’immortalité des deux Républiques
» (françaises et cisalpine) va se transformer en marche
triomphale, pour se terminer à Paris fin septembre. L’arrivée
à Paris ne semble pas avoir été tellement triomphante.
Avant de parler de la rencontre de Robertson avec Volta,
il faut revenir quelques mois en arrière. Comme indiqué
précédemment, l’invention de Volta est publiée
dans le Courrier de Londres fin août 1800 et va avoir quelques
échos en France, d’abord de la part de Robertson, mais pas
seulement de lui, ce qui n’apparaît pas dans l’œuvre
de Figuier.
Robertson reconnu comme le premier expérimentateur du galvanisme
en France, reprend les « Nouvelles d’Angleterre » sur
Volta dans plusieurs articles du Journal de Paris autour du 15 fructidor
(début septembre 1801) et, dans une communication à l’Institut
de France le 11 fructidor (29 août), il relate ses « Expériences
nouvelles sur le fluide galvanique », communication publiée
dans les Annales de chimie (TXXXVII — Année 1801). Ce même
tome des Annales comporte également un article du citoyen Desormes,
« Expériences et observations sur les phénomènes
physiques et chimiques que présente l’appareil électrique
de Volta ». Or, Charles-Bernard Desormes n’est pas un inconnu.
Né à Dijon en 1777, il est entré à l’École
Centrale de Travaux Publics (future École Polytechnique) dans
la première promotion de 1794. Retiré en 1797, il reste
comme préparateur de chimie à l’École et est
l’auteur, avec Guyton, professeur de chimie, d’une étude
sur l’analyse et la recomposition des alcalis et des « terres
». Desormes aura pour gendre Clément, également
dijonnais, qui s’intéresse à la chimie, les deux
hommes signeront plusieurs communications des deux noms Clément-Desormes,
si bien que certains biographes feront de ces deux savants une seule
personne !
Nous passerons rapidement sur la communication de Robertson, longuement
rapportée par Figuier. A remarquer toutefois, l’intérêt
porté aux effets physiologiques du « contact galvanique
» sur différentes parties du corps. Il utilise une pile
de 65 pièces de zinc et autant d’argent et rapporte les
sensations éprouvées par contact avec le bout du nez,
le menton, la langue, les « dents œillères »
(canines supérieures). Il remarque que les femmes et les enfants
sont plus sensibles, et va jusqu’à payer de sa personne
en s’enlevant avec un rasoir la surface de l’ épiderme
du pouce de la main et celle du petit doigt de pied : « la douleur
ou plutôt la brûlure éprouvée était
si insupportable qu’il m’était impossible de prolonger
le contact ».
La grande question est évidemment de savoir si ce fluide «
galvanique » est apparenté au fluide électrique,
et s’ils sont même identiques. Robertson reconnaît
que « les meilleurs conducteurs de l’un et de l’autre
sont l’homme, l’eau et les métaux ». Mais il
voit certaines différences et n’ose se prononcer définitivement.
Robertson constate aussi que, dans ses expériences, « l’
électromètre n’a jamais indiqué l’existence
de fluide électrique », car les électromètres
à paillettes ou feuilles d’or utilisés à l’époque
ne sont guère sensibles. Par contre, l’emploi de «
galvanomètres » détectant le fluide « galvanique
» par effet chimique de décomposition de l’eau et
dégagement de gaz donne des résultats positifs. Robertson
décrit ainsi deux de ces appareils à tube de verre droit
ou courbé. C’est probablement la première fois qu’on
utilise ce terme de « galvanomètre » qui montre bien
qu’on s’occupe d’un phénomène galvanique
dont on n’est pas sûr qu’il soit électrique.
Plus tard, cet appareil sera connu sous le nom de « voltamètre
».
Parlons maintenant de l’article de Desormes, moins
connu car Figuier n’en parle pas. Les préoccupations de
l’auteur sont ici surtout d’ordre chimique et, à part
quelques considérations, toujours relatives aux sensations physiologiques
de la pile (couples constitués de plaques cuivre-zinc plongés
dans des bocaux de verre emplis d’eau et reliés entre eux),
il étudie les variations de poids des plaques, les dépôts
Bonaparte et les savants provoqués par la corrosion. Il n’y
aurait rien de très excitant si Desormes n’évoquait
deux idées intéressantes :
— d’abord; il parle des expériences d’Hassenfratz,
professeur de physique à l’École Polytechnique, qui
a tenté d’effectuer la décompo sition de l’eau
par l’électricité obtenue avec une machine de Naime
en plongeant dans un vase plein d’eau, deux fils de laiton reliés
aux côtés positif et négatif (on ne parle pas encore
de « pôle ») de la machine ; rien ne se passe mais,
si l’on ajoute à l’eau de l’acide acétique
(vinaigre) le fil attaché au côté positif de la
pile se couvre « d’oxide » (on utilise alors peu le
y), alors que l’autre n’est pas attaqué.
Parlant de l’électricité produite par le contact
de deux métaux différents, démontrée, dit-il
par « le célèbre professeur de Pavie », il
cite un mémoire de Hot, présenté à l’Institut,
qui donne un « classement des métaux suivant leur rapport
d’ oxidation » (échelle électrochimique). On
aurait pu déterminer ce classement d’après «
le nombre de pièces métalliques suffisantes pour produire
le plus grand effet », mais Hot a utilisé un moyen plus
simple et plus rapide, en se basant sur la sensation ressentie par le
contact de la langue, « avec le zinc on a toujours une sensation
au contact des autres métaux, alors qu’avec l’argent,
ou tout autre métal, la sensation ne s’éprouve plus
au contact, mais dans le moment de rupture de la chaîne ».
Décidément, la langue est le meilleur électromètre
connu alors ! et Desormes donne le classement des métaux établi
par Hot, qu’il a complété par ses propres expériences
: zinc, plomb, fer, étain, anti¬ moine, mercure, bismuth,
cuivre rouge, platine, or, argent, plombagine. Il parle ensuite des
substances conductrices autres que les métaux : potasse, muriate
d’ammoniaque, soude, sulfates et borates de soude, etc.
Ceci montre que Hot et Desormes étaient bien près des
célèbres découvertes annoncées par Davy
quelques années plus tard : décomposition des alcalis
par l’électricité et découverte des métaux
alcalins ; découverte par le même de la protection contre
la corrosion par galvanisation. Les savants français ont raté
là une belle occasion de se distinguer !
— autre idée originale : celle relative à la construction
de piles sèches. Desormes « veut voir s’il ne serait
pas possible de former un appareil (une pile) sans substance humide
». Il utilise du charbon et de la plombagine et trouve qu’une
pile de 30 pièces de zinc et d’argent ne produit guère
plus d’effet qu’un seul couple, mais constate aussi que la
pression augmente beaucoup l’effet et, « lorsqu’on éprouve
la saveur avec la langue, cette sensation augmente à mesure que
l’on comprime la pile (...). En établissant soi-même
la communication, lorsque l’appareil est de 100 pièces zinc
et argent, l’espèce de commotion que l’on éprouve
est insupportable ; malgré cela, l’ électromètre
le plus sensible n’est presque pas affecté et la seule manière
de bien reconnaître l’électricité est, comme
l’ont fait M. Volta et d’autres physiciens, de se servir du
condensateur ».
Figuier indique dans une note que, en 1803, Hachette et Desormes avaient
construit une pile sèche en interposant entre les couples métalliques
des couches de colle d’amidon. En réalité, l’idée
de Desormes date de 1801, et sa pile était réellement
sèche. La découverte est pourtant attribuée au
genevois Deluc, qui présenta son appareil à la Société
Royale de Londres. Puis, Zamboni, professeur de physique à Vérone,
prendra la suite en 1812. Desormes conclut : « Tels sont les faits
jusqu’à présent observés, je ne conçois
pas comment il est possible de les expliquer par la simple théorie
de M. Volta, je me garderai bien d’en proposer une autre, tant
qu’elle ne pourra être fondée sur des expériences
plus nombreuses. Au reste, le zèle et l’activité
des physiciens doivent nous faire espérer que bientôt nos
connaissances sur cet objet seront exactes et certaines ».
Telles sont donc les connaissances que les Français
ont sur les travaux de Volta et sur la pile lorsque le savant italien
arrive à Paris, en septembre 1801 (an X et non IX comme écrit
chez Figuier, et même Robertson). Dans ses mémoires, Robertson
raconte comment il fait la connaissance de Volta, presque fortuitement
le 9 vendémiaire an X (2 octobre 1801). Exécutant dans
son cabinet de physique des expériences publiques sur le galvanisme,
il exprime des doutes sur l’identité des fluides électrique
et galvanique, lorsque l’un des assistants, le docteur Brugnatelli,
lui signale que M. de Volta aurait grand plaisir à dissiper ces
doutes. Le lendemain, Volta se présente à son cabinet
« portant dans sa poche de petits appareils galvaniques et une
grenouille vivante ». Bien que les expériences ne réussissent
pas, du fait probablement de la mauvaise qualité de ses condensateurs,
Volta expose ses théories si brillamment que Robertson est convaincu,
et des relations amicales s’établissent. Robertson se fait
le guide de Volta dans le monde scientifique parisien. Il le conduit
à l’École de médecine, à l’École
Polytechnique (alors établie dans ses premiers locaux des communs
de l’ancien Hôtel de Condé, aujourd’hui Palais
Bourbon) et dans le cabinet de M. Charles (« physicien et habile
expérimentateur », bénéficiant depuis Louis
XVI d’une pension et du privilège d’installer son cabinet
dans une partie du Louvre, membre de l’Institut). Volta est très
étonné de constater que personne à Paris ne semble
s’intéresser au galvanisme et à sa pile, ce qui,
on l’a vu, n’est pas tout à fait vrai.
Finalement, l’Institut accueille le savant italien qui lit un mémoire
détaillé sur ses diverses découvertes au cours
de trois séances consécutives, les 16, 18 et 21 bmmaire
(8-10 et 12 novembre 1801). Il termine son exposé en réalisant
diverses expériences. Le Premier Consul assiste en personne à
la séance du 16 brumaire (fig. 3) et, à la fin de la séance,
il propose de décerner à Volta une médaille en
or destinée à « servir de monument à cette
découverte importante, qui jettera probablement un jour nouveau
sur la physique ». Il s’adresse à Fourcroy en notant
que « ces phénomènes appartiennent plus à
la chimie qu’à la physique » et qu’il devrait
donc s’en emparer .
Une commission est nommée pour répéter en grand
les expériences sur le galvanisme ; ses membres sont les grands
savants de l’époque : Laplace, Coulomb, Halle, Monge, Fourcroy,
Vauquelin, Pelletan, Charles, Brisson, Sabatier, Guyton et Biot ; elle
comprend donc aussi bien des physiciens que des chimistes et des mathématiciens.
Après avoir répété les expériences
de Volta, c’est Biot qui lit le rapport de la commission à
la séance du 11 frimaire (2 décembre 1801). Le rapport
reproduit en gros le mémoire de Volta, mais présente l’intérêt
de définir pour la première fois la théorie de
la « force électromotrice ». Biot se rend compte,
sinon des lacunes, du moins des compléments à apporter
au travail de Volta :
« Il reste à déterminer l’action mutuelle
des éléments métalliques de manière rigoureuse,
à chercher si elle est constante pour les mêmes métaux,
ou si elle varie avec les qualités d’électricité
qu’ils contiennent et avec leur température (...). C’est
alors qu’on pourra établir le calcul sur des données
exactes, s’élever ainsi à la véritable loi
que suivent dans l’appareil du citoyen Volta, la distribution et
le mouvement de l’électricité, et compléter
l’explication de tous les phéno¬ mènes que ces
appareils présentent. Mais, ces recherches délicates exigent
l’emploi des instruments les plus précis qu’aient inventés
les physiciens pour mesurer la force du fluide. Enfin, il reste à
examiner les effets chimiques de ce courant électrique, son action
sur l’économie animale, et ses rapports avec l’électricité
des minéraux et des poissons ».
Réflexions fort intéressantes, qui ouvrent la porte à
de vastes investigations, qui ne seront malheureusement guère
suivies d’effets, tout au moins en France. Les Anglais seront plus
rapides et plus fructueux avec Davy, et plus tard, Faraday.
Examinons quelques traits en rapport avec les conclusions
de Biot, en particulier à propos des qualités de Volta,
théoricien de la physique et des appareils disponibles à
l’époque pour l’étude de l’électricité.
On a parfois reproché à Volta de posséder peu de
connaissances mathématiques et d’être un piètre
théoricien. C’était un excellent expérimentateur,
qui comprit parfaitement la nécessité de mesurer les effets
de son appareil. Il écrit dans le Journal de physique de 1801,
(tome II) :
« Après avoir vu quel degré d’électricité
j’obtiens d’un seul de ces couples métalliques à
l’aide d’un condensateur, je passe à montrer qu’avec
2, 3, 4 couples bien arrangés et communiquant par des couches
humides, on a justement le double, le triple... de sorte que si, avec
un seul couple, on arrivait à électriser le condensateur
de façon à lui faire donner à l’ électromètre,
par exemple 3°, avec deux couples, on aurait 6° (...). Voilà
donc cette pile construite, elle ne donne pourtant pas encore de signe
à l’ électromètre sans le secours du condensateur.
Pour arriver à un degré entier de tension électrique
qu’on pourra à peine distinguer, étant marqué
par une demi-ligne (environ 1 mm) que s’écarteront les pointes
des paillettes, il faut qu’une telle pile soit composée
d’environ 60 couples cuivre-zinc, à raison d’un soixantième
de degrés que donne chaque couple ». (Avec nos unités
actuelles, la tension d’un tel couple est d’environ 1 volt).
Volta a très bien compris aussi la nécessité de
définir une unité fondamentale de tension (la «
force du flux électrique »). Il propose d’utiliser
un disque métallique suspendu au bras d’une balance à
une distance d au-dessus d’une surface conductrice, équilibrée
par un poids W. L’unité, équivalente à une
déviation de 0,35° de l’électroscope à
paillettes valait environ 13,3V dans notre système actuel4. Volta
ne pouvait supposer que son nom demeurerait éternellement célèbre
par la dénomination de Volt donnée en 1881 à l’unité
de tension électrique, plutôt que comme inventeur de la
pile.
A propos des premières connaissances sur les
grandeurs électriques et les appareils de mesure, qui constituent
un très vaste domaine, le Cours de physique et chimie expérimentales
à l’usage des élèves des lycées , publié
en l’an XII (1804 ou 1805) de Pierre Jacotot (dijonnais, premier
bibliothécaire de l’École Centrale de Travaux Publics,
puis professeur de physique et chimie à l’École Centrale
de la Côte d’Or, puis au Lycée de Dijon, enfin recteur
de l’Université de Dijon, en 1808), fournit des éléments
intéressants, un chapitre entier étant consacré
à la description des « électromètres »,
instruments servant à « reconnaître la présence
et l’énergie de l’électricité »,
réalisés sous des formes diverses, ainsi les « électrophores
» inventés par Wlik, professeur de physique à Stockholm
et le condensateur de Volta, « servant à manifester la
présence d’une électricité trop faible pour
être observée par les moyens ordinaires ».
Notons que ce cours de physique est la réédition d’un
Cours à l’usage des élèves des Ecoles Centrales
publié en l’an IX (1801), complété par quelques
chapitres justement relatifs à « L’électricité
des métaux que l’on met en contact » avec cette introduction
: « C’est au citoyen Volta, professeur de physique à
Pavie, que nous devons la connaissance et la théorie de ce nouveau
phénomène ». Il n’est plus question ici de
fluide galvanique, mais toujours d’électricité.
Revenons au rapport de Biot en décembre 1801. Dans une note annexe,
Biot essaie de soumettre la pile au calcul, d’après la théorie
du contact, mais les résultats calculés ne s’accordaient
que de très loin avec les résultats d’observation.
La commission propose — conformément au vœu exprimé
par Bonaparte — d’offrir la médaille de l’Institut
comme témoignage de satisfaction de la classe, « pour les
belles découvertes dont il vient d’enrichir la théorie
de l’électricité, et comme une preuve de sa reconnaissance
pour les lui avoir communiquées ». La médaille porte
l’inscription : « A Volta, séance du 11 frimaire an
X » (et non IX comme l’écrit Figuier). En même
temps, Volta reçoit une somme de 6 000 livres pour frais de route.
Pas un mot, bien sûr, sur le fait que Volta avait déjà
reçu de la Société Royale de Londres en 1794, sa
plus haute distinction, la médaille d’or Copley, et que
c’est à la Société anglaise qu’il avait
réservé en 1800 la primeur de sa découverte.
Les relations de Volta avec Bonaparte et la France
ne s’arrêtent pas là.
En 1801, Napoléon Bonaparte assiste à la présentation
de Volta devant l’Institut de France : le physicien montre sa pile,
énonce la loi des tensions, ainsi que la valeur des métaux
classés par ordre d’électropositivité décroissante,
du zinc à l’argent.

C'est ainsi que fut construite,sur l'ordre de Napoléon et aux
frais de l'Etat, la magnifique pile voltaïque de l'École
polytechnique. Cette pile était composée de 600 cellules
de cuivre et de zinc de 9 décimètres carrés pour
chaque plaque ; toute la batterie avait 54 mètres carrés
de surface.
Par la suite de nombreux inventeurs vont améliorer ce procédé
en trouvant d’autres combinaisons susceptibles de fournir plus
d’électricité avec moins d’inconvénients
d’utilisation.
Volta quitte Paris en décembre 1801. Bonaparte le fait nommer
député de l’Université de Pavie et il est
« prié » à ce titre de passer par Lyon pour
prendre part à la réunion de la Consulta chargée
d’organiser la république cisalpine. La session se tient
au début de pluviôse an X (fin janvier 1802) et les députés
italiens ont la bonne idée — tout à fait spontanée
! — de désigner le Premier Consul comme président
de cette république « sœur ».
Un peu plus tard, Volta est nommé dans la première liste
d’associés étrangers de l’Institut National.
Il sera chargé d’honneurs, sénateur en 1809 du royaume
d’Italie (dont le roi est Napoléon), anobli comme comte
d’Empire par lettres patentes du 11 octobre 1810, avec des armes
comportant « un quartier de gueule à une pile voltaïque
et un conden¬ sateur d’argent ». Napoléon a donc
tenu la promesse de Bonaparte de porter quelques savants éminents
au sein de la noblesse d’Empire.
Bonaparte éprouve le désir d’encourager
les travaux relatifs au galvanisme et fonde un prix « à
décerner par l’Institut en faveur du physicien qui réaliserait
la découverte la plus importante en ce domaine ». Le 26
prairial an X (juin 1802), il écrit de Paris (et non d’Italie,
d’après Figuier) au ministre de l’Intérieur
Chaptal, une lettre en ce sens. La classe de l’Institut nomme une
commission (Laplace, Halle, Coulomb et Biot) pour tracer le programme
du concours. Le 11 messidor (1er juillet 1802), Biot fait son rapport,
il est institué un prix annuel consistant en une médaille
de 3 000 F et un grand prix d’encouragement de 60 000 F pour «
celui dont les découvertes formeront dans l’histoire de
l’électricité et du galvanisme, une époque
mémorable ». Bonaparte écrivait dans sa lettre :
« celui qui fera faire un pas comparable à celui qu’ont
fait faire à ces sciences Franklin et Volta ». Il s’agissait
donc bien d’une récompense insigne, si mémorable
qu’elle ne sera jamais décer¬ née, la chute de
l’Empire ayant évidemment mis fin prématurément
à ce concours !
Il est précisé que « tous les savants d’Europe,
les membres même et les associés de l’Institut sont
admis à concourir ». On se demande pourquoi le concours
est limité à l’Europe, alors que la lettre de Bonaparte
évoquait l’américain Franklin et visait « les
savants de toutes les nations ». Le rapport est adopté
à Funanimité par l’Institut le 17 messidor, et le
programme imprimé rendu public ...
Du point de vue scientifique, disons qu’après sa découverte géniale, un peu due au hasard et basée sur des hypothèses discutables, Volta ne produira plus rien d’important et, ce sont essentiellement les physiciens et chimistes anglais qui vont exploiter au mieux la pile comme source d’électricité pour leurs expériences.
1802 Nicolas Gautherot constate lors d’expériences d’électrolyse de l’eau que les électrodes en platine utilisées restent polarisées après l’expérience (par adsorption d’oxygène et d’hydrogène) et observe en court-circuitant ces deux électrodes un courant « secondaire ». Le terme de batterie secondaire qui tient son origine de ces courants secondaires, est associé aux batteries rechargeables.
1802 le Docteur William Cruickshank conçut
la première batterie électrique capable d'être produite
en série.
Sir Humphry Davy installa la plus grosse et la plus puissante batterie
électrique dans les chambres fortes de la 'Royal Institution'
de Londres. Il raccorda la batterie à des électrodes en
charbon et produisit la première lumière électrique.
Comme il le fut rapporté par des témoins, sa lampe voltaïque
à arc produisit « l'arc ascendant de lumière d'une
brillance encore jamais vue »
Cruickshank arrangea des feuilles carrées de cuivre soudées
à leurs extrémités et intercalées avec des
feuilles de zinc de même taille. Ces feuilles étaient placées
dans une longue boîte en bois rectangulaire qui était ensuite
refermée étanchement à l'aide de ciment . Des encoches
à l'intérieur de la
boîte permettaient de maintenir les plaques métalliques
bien en place. La boîte était remplie d'une solution aqueuse
salée (saumure) ou d'acide dilué.
Jusqu'à une certaine époque toutes les batteries comportaient
des éléments/accumulateurs primaires, ce qui voulait dire
qu'elles n'étaient pas rechargeables.
1802 La pile à auge était une variante
de la pile Volta, inventée par William Cruickshank
La pile Volta était formée d'un empilement de disques
de zinc et de cuivre séparés par des disques de feutre
imbibés de saumure. La pression de la colonne sur les disques
du bas provoque un assèchement des cylindres de feutre qui finissent
par ne plus contenir d'électrolyte.
Cruickshank a résolu ce problème en plaçant la
pile horizontalement dans une boîte rectangulaire. La pile (au
sens empilement) n'en est plus une, même si le nom est resté.
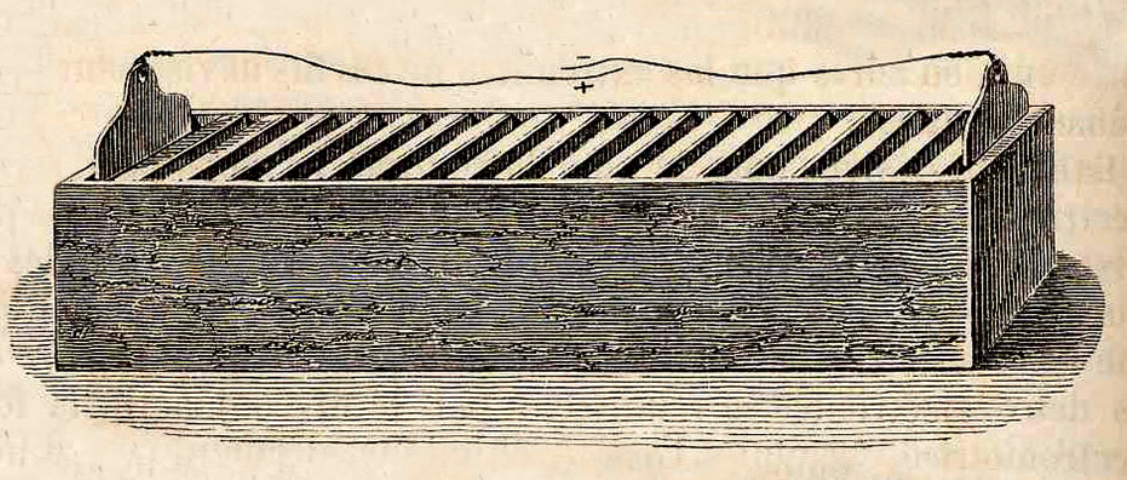

L'intérieur de la boîte était isolé à
l'aide de gomme-laque, et des paires de plaques de zinc et de cuivre
(ou d'argent) de grande surface étaient placées dans la
boîte de manière régulière. L'espace entre
les plaques (les auges) était rempli d'acide sulfurique dilué
ou de chlorure d'ammonium. Tant que la caisse ne bougeait pas, il n'y
avait aucune déperdition d'électrolyte. La pile contenait
typiquement une soixantaine de cellules.
Du fait de la taille des plaques, agrandie par rapport au modèle
de Volta, la résistance interne devient beaucoup plus faible.
Les piles à auge ont pu être associées en batterie.
Autour de 1810, plusieurs centaines d'auges seront reliées, à
la Royal Institution de Londres ou à l'École Polytechnique
de Paris. Elles seront fréquemment utilisées pour les
expérimentations d'électrochimie au début du XIXe
siècle, incluant celles de Humphry Davy, qui isole le sodium
et le potassium grâce aux tensions atteintes par ces piles.
A la demande explicite de l'Empereur Napoléon Bonaparte, une
pile du même type fut réalisée à l'Ecole
Polytechnique. Elle fut utilisée par de nombreux savants et par
Ampère lui-même pour des expérimentations scientifiques.
1819 La Pile en hélice
Dans la pile en hélice imaginée par le chimiste américain
Robert HARE, les lames de cuivre et de zinc, séparée par
des lanières de drap, sont enroulées et placées
dans un récipient plein d'eau acidulée.
1815 La Pile de Wollaston
Afin de retarder la polarisation de la pile voltaïque, la chimiste
anglais William HydeWOLLASTON proposa une solution dans laquelle l'électrode
de cuivre entoure l'électrode de zinc.
De cette façon, la surface de l'électrode est doublée
et le fonctionnement de la pile est prolongé. Plusieurs éléments
sont montés en série pour obtenir la tension désirée.
La pile de MÜNCH est une variante de la pile de Wollaston
dans laquelle les lames de cuivre sont pliées en U dans le sens
vertical et viennent s'intercaler entre les lames de zinc.
1829 Cependant, le dépôt de minuscules bulles d'hydrogène
sur le cuivre freinait le passage du courant. Les chercheurs de l'époque
découvrirent que cet inconvénient était dû
à des phénomènes chimiques complexes auxquelles
on donna le nom de polarisation.
Un grand savant français, Antoine César Becquerel,
se préoccupa de cette question de polarisation et inventa en
1829 une pile qui évitait le phénomène parasite.
C'est la pile à deux liquides séparés. Becquerel
eut l'idée d'enfermer la plaque de zinc baignant dans l'eau acidulée
à l'intérieur d'un petit sac de baudruche, c'est-à-dire
d'une pellicule très fine fabriquée avec le gros intestin
du beuf, dont on faisait aussi des ballons. Le tout est plongé
dans un vase rectangulaire en cuivre rempli d'une solution saturée
de sulfate de cuivre. La baudruche empêche le mélange défavorable
des deux liquides, mais ne gène pas les phénomènes
électriques. Cet instrument est reconnu comme la première
pile à courant constant.
Le physicien Becquerel avait écrit :
« La pile porte avec elle la cause des diminutions qu’éprouve
le courant électrique ; car, dès l’instant qu’elle
fonctionne, il s’opère des décompositions et des
transports de substances, qui polarisent les plaques, de manière
à produire un courant en sens inverse du premier. L’art
consiste à dissoudre ces dépôts à mesure
qu’ils se forment, avec des liquides convenablement placés.
»
1832 Qui fut le premier à faire fonctionner
un télégraphe au moyen d'une pile ?
Cet honneur revient tout entier au baron Schilling, officier
de l'armée russe, qui construisit à Saint-Pétersbourg
le premier télégraphe à aiguilles électro-magnétique
qui utilisait six fils pour la signalisation, lors d'une démonstration
à Saint-Pétersbourg. Un projet avait été
lancé par le gouvernement pour l'installer en Russie, mais l'idée
a été abandonnée après la mort de Schilling.
C'est Samuel Morse, en 1837, aux États-Unis, qui constite
le point de départ du télégraphe électrique.
D'autres types de piles ont été inventés
qui peuvent se classer en deux familles principales :
- Les piles impolarisables dans lesquelles le passage du courant ne
modifie pas la nature des contacts électrochimiques,
- Les piles à dépolarisant dans lesquelles l'hydrogène
qui se forme au pôle positif doit être réduit par
l'oxygène sous peine de voir la pile cesser de fonctionner (polarisation).
Les piles actuelles font presque toutes partie de cette deuxième
famille.
1836 La Pile Daniell
Le physicien anglais John Frédéric Daniell,
membre de la Société Royale, eut l'idée de remplacer
la baudruche par un vase en terre de pipe poreuse, poreuse parce qu'elle
n'a été cuite qu'en partie. La pile de Daniell au chlorure
de platine, très proche de celle de Becquerel, eut un grand succès.
Elle fut longtemps utilisée par ceux qui recherchaient un courant
stable.
1840 La pile d'Oxford, ou de Clarencon

Ce carillon conservé à l'université d'Oxford (Angleterre)
est alimenté par la même pile expérimentale installée
au Laboratoire Clarendon depuis 1840. Il est aujourd'hui exposé
dans une vitrine, dans un couloir du foyer du laboratoire Clarendon,
au département de physique de l'université d'Oxford (Angleterre).
On ne l'entend plus, mais derrière les parois de verre, le battant
continue son mouvement d'une cloche à l'autre. Depuis au moins
1840, date de sa mise en service officielle, ce carillon n'a pas cessé
de sonner, émettant plus de 10 milliards de "dings"
et "dongs".
Le secret de cette longévité, c'est une pile, la même
depuis 176 ans. Baptisée "pile sèche de Clarendon",
elle a été placée sur le carillon par Robert Walker,
enseignant à l'université, pour une expérience.
C'est lui qui a placé une étiquette sur le carillon indiquant
qu'elle avait été mise en service en 1840. Mais d'autres
documents retrouvés à l'université laissent penser
que la pile a été fabriquée 15 ans plus tôt.
Aujourd'hui encore, cette pile intrigue les scientifiques, qui ne connaissent
pas exactement le secret de sa confection : ils n'osent pas la démonter,
de peur d'interrompre ce fonctionnement d'une durée record.
La pile de Clarendon ne fait pas exception : elle aussi fonctionne
avec une réaction chimique. Alors, pourquoi ne s'use-t-elle pas
? Le Dr A.J. Croft, du laboratoire Clarendon, a consacré un article
au carillon en 1984 dans l'"European Journal of Physics",
avec un descriptif précis. "La période est variable,
dépendant du temps. Les oscillations sont plus lentes lorsque
le temps est humide, et l'humidité amène le mouvement
à cesser de temps en temps. Il recommence sans assistance extérieure".
La pile, elle, est enrobée de soufre.
La pile de Zamboni est une variante de la "pile de Volta"
: les empilements de couches où se produisent les réactions
chimiques qui fournissent l'électricité sont branchés
"en série", ce qui fournit un voltage suffisant pour
les applications désirées, un peu comme s'il y avait des
milliers de mini-piles dont les puissances s'ajoutent.
Pour le Dr Croft, la pile d'Oxfordest "similaire à celles
qui étaient fabriquées par Zamboni, qui étaient
constituées d'environ 2.000 paires de disques de feuille d'étain
collés à un papier imprégné de sulfate de
zinc et recouvert de l'autre côté de dioxyde de manganèse.
Les piles ne sont pas sèches, mais contiennent la quantité
d'eau nécessaire pour fournir l'électrolyte sans causer
un court-circuit".
1838 La pile Grove est une pile électrique
du nom de son inventeur, le chimiste William Grove.
Elle consistait en une anode de zinc dans de l'acide sulfurique diluée,
et une cathode de platine dans de l'acide nitrique concentré.
Les deux liquides étaient séparés par un pot en
céramique poreuse.

L'invention de la pile Grove a fait l'objet d'un mémoire intitulé
: « Pile voltaïque d'une grande énergie électro-chimique;
par M. W. Grove », présenté pour la première
fois à l'Académie des Sciences de Paris par Henri Becquerel,
le 1er janvier 1839.
La pile Grove était la source d'énergie privilégiée
du télégraphe système américain au début
de la période 1840-1860 parce qu'elle offrait une sortie de courant
électrique élevée et une tension supérieure
à la pile Daniell (respectivement 1,9 et 1,1 volt).
Mais la pile Grove entraînait le dégagement de fumées
toxiques de dioxyde d'azote par réaction redox qui sont dangereuses
pour la santé.
Le 8 août 1839, le physicien russe d'origine prussienne Moritz
von Jacobi a utilisé à Saint-Pétersbourg sur la
Néva, une batterie composée de 64 piles Grove, en faisant
naviguer contre le courant un bateau propulsé par 40 moteurs
électriques de 700 W de son invention avec 14 passagers à
bord pendant 7 heures à une vitesse d'environ 4,2 km/h. Sa batterie
était particulièrement puissante mais onéreuse
car elle a nécessité 3 m2 de surface de platine.
1841 La pile Bunsen
On a vu, dans la Notice sur la Pile de Volta, des Merveilles de la science,
comment le physicien Grove, pour produire la dépolarisation du
zinc, le phénomène funeste qui arrête la continuation
du courant, fit usage d’acide azotique, qui détruit l’agent
polarisateur, c’est-à-dire le gaz hydrogène provenant
de la décomposition de l’eau, Nous avons dit aussi comment
Bunsen, profitant d’une première tentative du physicien
français Archereau, créa la pile à deux liquides
(acides azotique et sulfurique) connue aujourd’hui sous le nom
de pile de Bunsen.
 Pile Bunsen
Pile Bunsen
En 1843, le chimiste allemand Robert Wilhelm BUNSEN perfectionne la
pile de GROVE en remplaçant l’électrode en platine
par une électrode en charbon artificiel, beaucoup plus économique.
Cette pile convient parfaitement à l’éclairage électrique
à condition d’associer plusieurs éléments
: une trentaine au minimum pour un arc électrique. Elle consistait
en une anode de zinc dans de l'acide sulfurique dilué, et une
cathode de carbone dans de l'acide nitrique concentré. Les deux
liquides étaient séparés par un pot en céramique
poreuse. C'est une modification de la pile Grove, Bunsen ayant remplacé
la cathode de platine par une électrode de carbone.
L’abbé MOIGNO écrit dans la revue “Les Mondes”
du 24 juillet 1879 « Après trois mois d’expériences
et d’observations constantes, nous avons pu constater que la dépense
de la pile, pour une lampe à incandescence, est d’environ
un litre d’acide nitrique et d’eux litres d’eau acidulée
par jour, et celle de la lampe de 15 à 20 centimètres
de charbon par heure. » Ce type de pile, qui porte le nom de son
inventeur, sera perfectionné par la suite par Georges LECLANCHE.
Les Piles au bichromate de potasse
Diverses améliorations (pile TROUVE,
pile CARDIN, pile VOISIN et DROBIER…) suivront pour isoler cette
électrode.
Piles à treuil 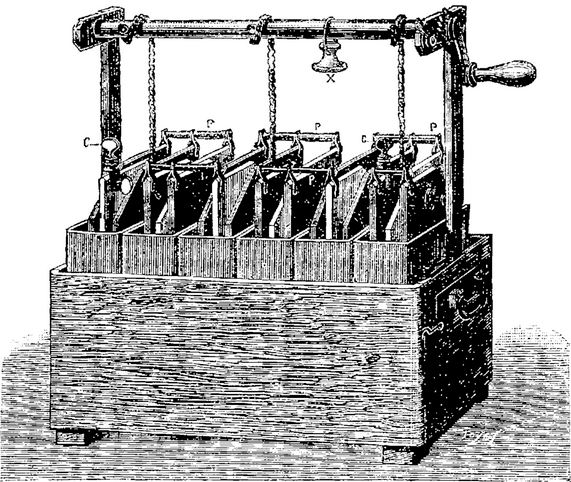 Trouvé
Trouvé 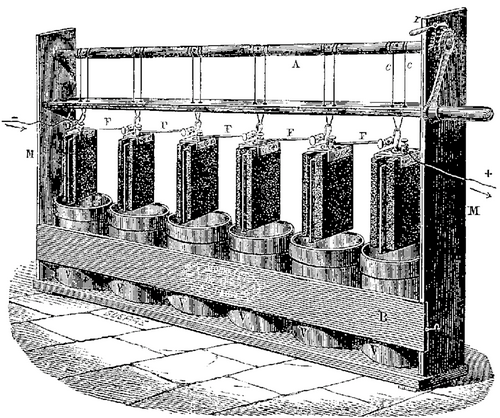 Ducretet
Ducretet
|
M. Gustave Trouvé a découvert
le moyen de lui fournir une constance grandement suffisante pour
les usages domestiques et médicaux, tout en lui conservant
sa simplicité et son intensité primitives. Voici
la modification qu'il a imaginée et qui est très
ingénieuse.
|
M. Fuller, physicien anglais, a construit un
élément au bichromate de potasse qu’utilise avantageusement
l’administration des télégraphes du Post-Office de
Londres. Cet élément est disposé de la manière
suivante. Un zinc, de forme pyramidale, et dont la base baigne dans
du mercure recouvert d’eau acidulée, occupe le fond du vase
poreux. Autour de ce dernier et dans le vase extérieur, se trouve
l’électrode de charbon, qui plonge dans un mélange
de bichromate de potasse et d’acide sulfurique étendu d’eau.
Cet élément, dont la force électro-motrice est
de 2 volts et la résistance égale à 1 ohm, est
très intense, assez constant et très économique.
Les lignes télégraphiques anglaises ont employé
plus de 20 000 éléments ; ce qui est une preuve suffisante
de ses qualités, au point de vue de la télégraphie.
La Pile Camacho. M. Camacho obtient la dépolarisation
de la pile au bichromate de potasse en disposant les éléments
en cascade, ce qui établit la circulation du liquide, et en augmente
la surface du charbon. La figure ci-dessus donne le dessin exact de
la pile Camacho.
Les vases contenant la solution de bichromate de potasse sont placés
sur des gradins, et comme en escalier. D’un réservoir supérieur
A, le liquide excitateur tombe dans le vase poreux de l’élément
le plus élevé ; il en sort par la partie inférieure
de ce vase, et au moyen d’un siphon en caoutchouc, B, il passe
dans le vase poreux suivant, et ainsi de suite. L’électrode
négative (charbon) est composée d’une tige de charbon
de cornue et d’une masse convenable de fragments de charbon, qui
remplit tout le vase poreux. La surface énorme que représente
l’électrode rend très lente la polarisation de cette
pile. Au bout de quelque temps de service il faut laver les vases poreux
et l’électrode, en faisant passer, au lieu du liquide acide,
de l’eau pure, qui le débarrasse du dépôt de
chrome qui s’y est formé, par la réaction chimique.
ET :
Dans la batterie de M. Stohrer, la surface du charbon est totalement
utilisée et les plaques de zinc plus étroites que celles
du charbon, ce qui est encore un avantage.
M. Chuteaux remplace, dans son élément, la solution
ordinaire de bichromate par un mélange formé d’eau,
de bisulfate de mercure, de bichromate de potasse et d’acide sulfurique.
En outre, il dispose ses éléments d’une façon
très ingénieuse, qui en facilite la vidange. Cette pile,
qui est peu constante, fut utilisée pendant le siège de
Paris, pour l’éclairage électrique.
M. Delaurier emploie un mélange plus économique
que les précédents, et qui consiste en 5 parties de bichromate
de potasse, 5 de sulfate de soude, 4 de sulfate de fer, 25 d’acide
sulfurique à 66° B. et 30 d’eau.
M. Cloris Baudet a construit une pile impolarisable à
courant constant qui est douée d’une grande force électro-motrice.
Cette pile, qui ne dégage aucune odeur et n’occasionne qu’une
très faible dépense, peut s’appliquer indifféremment
à la télégraphie, aux moteurs électriques
et aux horloges électriques, à la galvanoplastie, à
la lumière électrique, à la médecine, etc.,
etc. ; Elle est à un ou deux liquides, suivant l’usage auquel
on la destine.
La pile à un seul liquide se compose : d’un vase de grès,
rempli d’une dissolution de bichromate de potasse, de sel marin
et d’acide sulfurique, dans laquelle plonge une lame de charbon
; et d’un vase poreux, à trois compartiments, plongeant
aussi dans le vase de grès ; l’un des compartiments contient
des cristaux de bichromate de potasse, l’autre de l’acide
sulfurique, et celui du milieu, qui est percé d’un trou
à sa base, afin de permettre au liquide extérieur d’y
pénétrer, contient une lame de zinc.
La pile à deux liquides est formée des mêmes éléments
que la première, mais le compartiment du milieu du vase poreux
est rempli d’une dissolution de sel marin. M. Cloris Baudet a également
construit une batterie à courant constant, qui doit cet avantage
à ce que les liquides de la pile se renouvellent constamment
autour des éléments. Cet écoulement a pour effet
de maintenir les liquides dans le même état, et d’éviter
les métallisations et les encrassements. La pile étant
montée une première fois, l’entretien se borne à
remplir les réservoirs lorsqu’ils sont vides ; ce qu’on
peut faire sans arrêter le fonctionnement de la pile, et à
changer les zincs lorsqu’ils sont usés.
M. le capitaine Putot a imaginé, pour les opérations militaires,
une pile au chlorochromate de potasse, qui donne d’excellents résultats.
Elle se compose de quatre éléments associés en
tension. Chaque élément est formé d’un cylindre
en zinc, au milieu duquel est un bâton de charbon. Ils sont placés
en carré, et noyés tous les quatre dans une masse cylindrique
de gutta-percha.
Le mélange excitateur est formé de 6 grammes de bisulfate
de potasse et de 20 grammes de chlorochromate de potasse dissous dans
100 grammes d’eau acidulée.
Pour actionner les machines à coudre, M. Griscom a construit
une batterie à bichromate, dans laquelle le relèvement
des éléments s’opère à l’aide
d’un ressort que l’on met en action en pressant plus ou moins
sur un levier angulaire, ce qui les fait plonger plus ou moins dans
le liquide excitateur. On peut ainsi modérer ou accélérer
la marche de la machine, et même l’arrêter complètement.
M. Partz a aussi perfectionné la pile au bichromate et
en a fait une pile à courant constant, qui ne s’use que
quand le circuit est fermé. Dans chaque élément,
le liquide excitateur est composé d’une solution de bichromate
d’ammoniaque et de chlorure de zinc, dans laquelle plongent une
lame de zinc et une plaque de charbon de cornue.
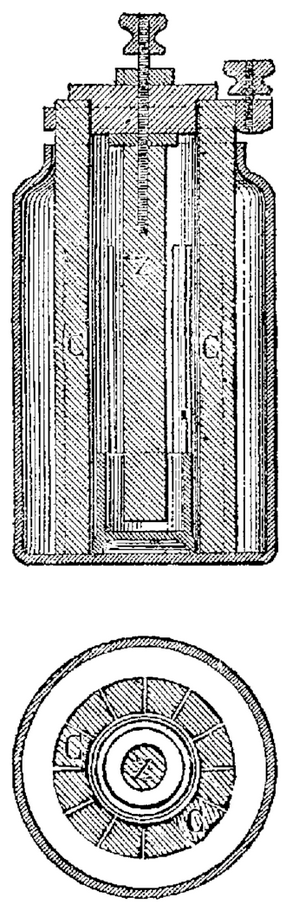 Coupe et plan de la pile
au bichromate d’ammoniaque de M. Partz.
Coupe et plan de la pile
au bichromate d’ammoniaque de M. Partz.
Le liquide est sans action sur le zinc tant que le courant n’est
pas fermé. Dès que la communication est établie
entre les deux pôles, la pile travaille : le bichromate d’ammoniaque
est décomposé, et il se forme sur le zinc un dépôt
de couleur olive, formé de chromo-oxychlorure de zinc, qui se
détache bientôt du zinc, comme d’une enveloppe, en
laissant le métal à nu. Il se dégage, du pôle
positif, du gaz hydrogène et de l’ammoniaque, grâce
à l’élimination des produits de la réaction
qui se fait soit par la précipitation du composé insoluble,
soit par le dégagement gazeux. Le liquide conserve une composition
constante. Il suffit donc, pour entretenir le courant, de renouveler
le sel et de remplacer le zinc, quand il est usé.
Le pôle négatif de la pile Partz est un morceau de charbon
de cornue formant un cylindre creux que l’on a scié extérieurement
dans le sens de la longueur de manière qu’il forme une rangée
circulaire de barres de charbon C, C, ainsi qu’on le voit par la
coupe que présente la figure 323. La baguette de zinc Z, qui
forme le pôle positif, est suspendue au milieu de ce cylindre.
Par sa partie inférieure le zinc plonge dans un petit vase plein
de mercure, M, placé au fond. La pile Partz est d’un grand
usage en Amérique.
Enfin, MM. Grenet et Jarriant ont construit
une batterie au bichromate de soude et à un seul liquide, qui
a servi à l’éclairage du Comptoir d’escompte
de Paris.
En 1883, la pile au bichromate de potasse de MM. Grenet et Jarriant,
fut employée pour l’éclairage électrique du
Comptoir d’escompte à Paris. Mais les résultats se
montrèrent très défavorables ; car, au bout de
quelques mois, l’éclairage électrique et la pile
au bichromate de potasse furent supprimés.
1850 La pile de GRENET
La formule initiale de cette pile découle des travaux de
Poggendorff qui préconisa d'utiliser le couple carbone/zinc comme
dans la pile Bunsen, mais en dissolvant du dichromate de potassium dans
l'électrolyte constitué par une solution d'acide sulfurique.
La pile de Grenet, conforme à cette formule, est proposée
à partir des années 1850.
La pile GRENET est une pile à un seul liquide, avec des électrodes
en charbon et en zinc amalgamé (préalablement trempé
dans du mercure) plongées dans une solution de bichromate additionnée
d’acide sulfurique. Quand la pile n’est pas utilisée,
il est nécessaire de relever l’électrode centrale
en zinc pour la préserver.


La pile GRENET, aussi appelée pile bouteille à cause de
sa forme, se compose d’un corps en verre contenant une solution
acide de bichromate de potassium dans laquelle sont plongées
des électrodes fixées sur le couvercle en ébonite.
Les charbons, reliés à une borne en cuivre, sont fixés
définitivement tandis que la plaque en zinc située entre
les deux charbons, relié à l’autre borne en cuivre,
peut coulisser verticalement à l’aide d’une tige en
laiton retenue par une vis afin de l’économiser lorsque
l’on ne se sert pas de la pile. Celle-ci peut fonctionner neuf
à dix heures et suffit pour pratiquer certaines expériences
ou alimenter une ampoule électrique de faible consommation.
On trouvait dans le commerce des piles de différentes tailles
suivant les applications à alimenter.
Les plus petites piles que l'on retrouve avaient un volume d'environ
1/4 de litre et les plus grosses pouvaient avoir une hauteur de plus
de 30 cm et contenir plusieurs litres d'électrolyte.
La pile brevetée par le Dr A. Vincent était une
variante de la pile de Grenet qui était équipée
d'un syphon latéral qui permettait de remplacer l'électrolyte
au fur et à mesure de son usure pendant le fonctionnement de
la pile.
La pile VOISIN et DRONIER est une autre variante de la pile bouteille.
La pile "à treuil" inventée par Gustave
TROUVE (1838-1902) constructeur français d'instruments scientifiques
en est un autre exemple. Les électrodes de cette pile étaient
équipées d'un système de relevage à manivelle.
Dans certaines piles, la dépolarisation s’effectue
par le chlore, et non par l’oxygène ou les oxydes métalliques
: ce sont les piles dites à chlorures.
La première de ce genre (après celle de Daniell au chlorure
de platine) est la pile de M. Marié Davy, au chlorure
d’argent.
Chaque élément se compose d’un vase extérieur,
en forme de cylindre, de 13 centimètres de long et de 3 centimètres
de diamètre, dans lequel un crayon de zinc non amalgamé
tient lieu d’électrode soluble. Au crayon est soudée
une lame d’argent, qui constitue le pôle du couple suivant,
et autour duquel on a fondu un petit bâton de chlorure d’argent
(pôle positif) qu’on isole à l’aide d’un
petit cylindre en papier parchemin. Le vase extérieur est fermé
par un bouchon en paraffine, et contient une dissolution de chlorhydrate
d’ammoniaque formée de 23 grammes de sel pour 1 000 d’eau.
Cette pile, dont le comburant est un corps solide, insoluble, qui n’a
d’autre rôle que de fournir le chlore nécessaire à
la dissolution du zinc, est à courant constant, et ne s’use
que quand son circuit est fermé. Sa résistance dépend
de son temps de service et de la grandeur de chaque élément.
Quant à sa force électro-motrice, elle est relativement
énergique.
Pile au chlorure d’argent de M. Warren de la Rue. 
La pile au chlorure d’argent, imaginée par M. Marié
Davy, en 1860, a été perfectionnée en 1868, par
M. Warren de la Rue, qui lui a donné la forme que représente
la figure ci-dessus.
M. Marié Davy a encore essayé, comme dépolarisant,
le chlorure de plomb. Mais vu le prix assez élevé de ce
corps et le peu d’énergie des éléments au
chlorure, cette pile n’a pas reçu d’application.
M. Duchemin a essayé, mais sans succès, de dépolariser
les piles au moyen du perchlorure de fer.
M. Niaudet a construit une pile constante et assez énergique,
dans laquelle il utilise les propriétés dépolarisantes
du chlorure de chaux.
Dans le vase poreux, on place une plaque de charbon, autour de laquelle
on entasse du charbon concassé, puis une couche de chlorure de
chaux, une nouvelle couche de charbon, etc., etc., jusqu’à
ce qu’on arrive au bord supérieur ; on ferme le tout avec
une couche de poix. À la distance voulue, et retenu par de petits
bâtons en bois, le vase poreux est entouré d’un cylindre
de zinc, qui trempe dans de l’eau salée, où il peut
rester impunément, puisque ni ce sel, ni le chlore ne peuvent
l’attaquer.
Le vase poreux, ainsi que le cylindre de zinc qui y est fixé,
sont cimentés avec le col du vase, pour éviter tout dégagement
de chlore, et on ne laisse qu’une ouverture pour le remplissage
de l’eau salée, que l’on prépare en dissolvant
dans 100 parties en poids d’eau 24 parties de sel de cuisine, proportion
qui donne la plus petite résistance.
Au début, la force électromotrice est de 1,5 volt, mais
elle tombe, au bout de quelques mois, à 1,38 volt. Toutefois,
la réduction de l’hydrogène ne se fait pas complètement
; de sorte que la force électro-motrice peut tomber à
1,28 volt, même à 1,03 si l’on ferme la pile à
court circuit ; mais il suffit d’un court repos pour qu’elle
reprenne sa force primitive.
Enfin Gaiffe a construit une petite pile au chlorure d’argent.
L’élément se compose d’un petit cylindre de
caoutchouc durci, qui porte un couvercle vissé se fermant hermétiquement.
Les deux électrodes sont fixées au couvercle par des écrous.
L’électrode négative est un petit creuset en cuivre
qui contient du chlorure d’argent fondu, enveloppé dans
de la toile. De petits buttoirs de caoutchouc assurent la distance nécessaire
de l’électrode zinc, et un bracelet en caoutchouc les serre
tous deux contre ces buttoirs.
Cet élément qui contient du liquide ne peut pas être
retourné, puisque quand le couvercle est mouillé il se
produit aussitôt une fermeture ; aussi Gaiffe remplaçait
d’ordinaire le liquide par des couches de papier buvard imprégné
d’une dissolution de chlorure de zinc à 5 pour 100.
Ces éléments sont très économiques et très
commodes pour les usages médicaux.
De même que le chlore, l’iode, le brome et le soufre ont
été employés comme dépolarisants.
Ainsi, M. Laurie a construit une pile dont les électrodes
plongent dans une dissolution d’iodure de zinc, à laquelle
on ajoute de l’iode.
Dans l’élément de M. Doat, le vase extérieur
contient du mercure, où plonge un fil de platine, et le vase
poreux renferme une dissolution d’iodure de potassium qui entoure
le charbon.
M. Regnault a remplacé l’iode par le brome et l’iodure
de potassium par du bromure, sans obtenir de meilleurs résultats.
Enfin MM. Blanc et Savary ont essayé de réduire
l’hydrogène par le soufre, et de construire, avec ce métalloïde,
des piles impolarisables.
Aucune de ces piles, dont la force motrice est d’ailleurs très
faible, n’a reçu d’application pratique.
1853 La pile de Callaud est aussi appelée
gravity battery.
Cette pile électrique, inventée par Armand Callaud en
1853, est constituée comme la pile Daniell d'un réservoir
contenant deux électrolytes différents, sulfate de cuivre
et eau acidulée, les deux solutions étant séparées
par simple différence de densité.
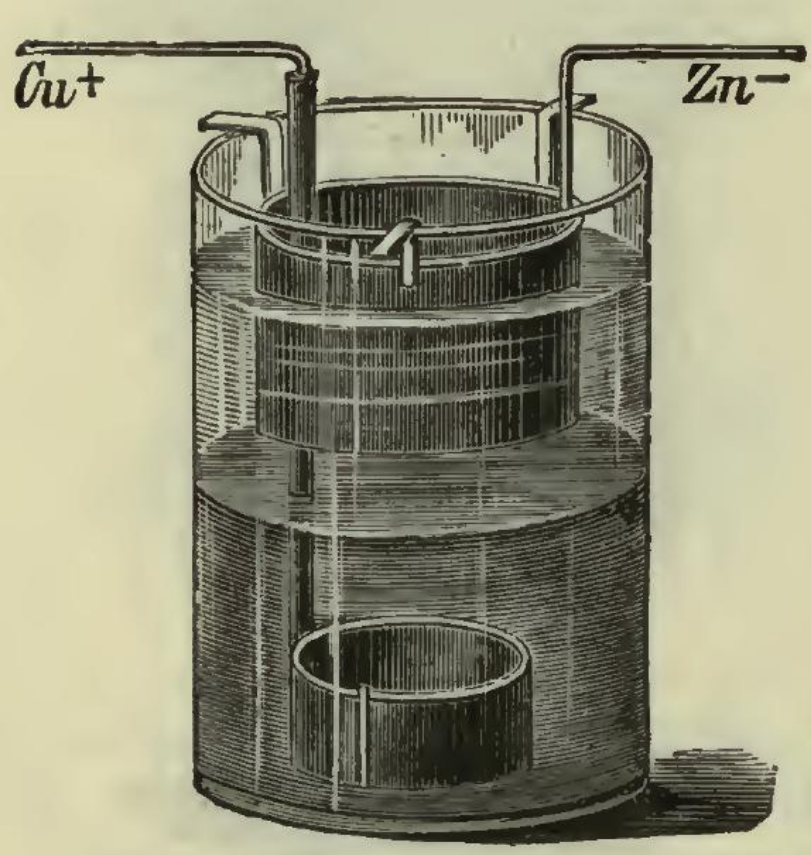
Cette pile doit débiter en continu, et rester immobile afin d'éviter
tout mélange des deux solutions. C'est pour cela que ce type
de pile fut employée pour la téléphonie.
1859 La pile Planté la pile secondaire
au plomb
Jusqu'à une certaine époque toutes les batteries comportaient
des éléments/accumulateurs primaires, ce qui voulait dire
qu'elles n'étaient pas rechargeables. En 1859, Le physicien français
Gaston Planté inventa la première batterie rechargeable.
La batterie secondaire était basée sur un couple chimique
acide plomb, qui est toujours utilisée de nos jours . Il l'améliore
en 1865 ; Camille Faure l'améliorera encore en 1881.
Nous manquerions à nos devoirs si nous ne signalions pas le nouvel
hommage qui a été rendu à la mémoire de
cet électricien aussi éminent qu’il était
modeste et désintéressé. Le jury lui a décerné
un grand prix d’honneur et le public s’est intéressé
vivement à la belle collection des éléments Planté,
parmi lesquels se trouvaient ses premiers types, ratifiant ainsi d’avance
le jugement qui, accordait au créateur des accumulateurs la plus
haute récompense de l’Exposition.
En France, une loi du 28 mars 1866 stipule que « un prix de cinquante mille francs (50,000f), à décerner dans cinq ans, est institué en faveur de l’auteur de la découverte qui rendra la pile de VOLTA applicable avec économie : soit à l’industrie comme source de chaleur ; soit à l’éclairage ; soit à la chimie ; soit à la mécanique ; soit à la médecine pratique. »
Bulletin des lois – 28 mars 1866 
Au lieu de produire un dégagement d’oxygène,
pour réduire l’hydrogène, cause de la dépolarisation
des piles, on peut se servir d’un oxyde métallique, qui
produise la même réduction de l’hydrogène.
Auguste de la Rive eut le premier l’idée de se servir
d’un oxyde métallique pour produire la réduction
de l’hydrogène, et par conséquent, la dépolarisation
du zinc. La pile à oxyde de manganèse proposée
par Auguste de la Rive ne fut jamais mise en usage, mais un physicien
français, Léclanché, construisit, trente
ans plus tard, une pile, qui repose sur le même principe, et qui
est adoptée aujourd’hui dans le monde entier.
La Pile Crosse
M. Crosse a imaginé quelques modifications qui peuvent donner
de bons résultats. L’électrode positive de ses piles
chromiques est constituée par un sac cylindrique en plomb, rempli
de fragments de coke ; l’électrode positive de ses piles
du genre Daniell, est de même formée d’un sac de plomb,
renfermant des cristaux de sulfate de cuivre.
Ce dispositif présente une grande surface et réduit conséquemment
la résistance extérieure des éléments.

La Pile Bazin
On a eu recours maintes fois à des moyens mécaniques pour
aider à l’action dépolarisante des liquides chromiques
: M. Bazin en est revenu à faire tourner sur elles-mêmes
les électrodes de charbon, d’une manière continue,
par l’action d’un petit moteur électrique. Les vases
de pile sont placés sur un support qu’on peut élever
ou abaisser à volonté pour mettre les éléments
en activité ou au repos : les charbons et leurs axes sont au
contraire fixes dans l’espace.
La Pile Renard 1896
Cette pile, rendue célèbre par les expériences
de direction du ballon la France, était exposée dans le
pavillon de l’aérostation militaire, suy l’Esplanade
des Invalides.
C’est une pile chlorochromique : le liquide excitateur est constitué
par une dissolution d’acide chromique dans de l’acide chlorhydrique,
de densité 1,088, Cro3 et Hc£ étant à équivalents
égaux ; le même liquide joue le rôle de dépolarisant,
car la pile est à un seul liquide. Le zinc est employé
sous forme de crayons cylindriques ; l’électrode conductrice
est formée d’une lame d’argent platinée sur
ses deux faces par laminage, de 1/10e de millimètre d’épaisseur.
Il est à remarquer que le zinc n’est pas amalgamé.
Le liquide est renfermé dans des tubes de verre relativement
longs, dont la hauteur égale au moins 10 diamètres, de
manière à présenter une surface considérable
de refroidissement. Les éléments sont réunis en
groupes qui constituent des faisceaux tubulaires.
Les piles du ballon la France étaient semi-tubulaires, c’est-à-dire
que chaque élément était formé de six tubes
assemblés en surface : les tubes avaient 40 millimètres
de diamètre. Un tel élément pouvait donner 120
ampères avec un potentiel utile de 1,2 volt.
Grâce à l’emploi du liquide chlorochromique, la pile
Renard peut fournir une puissance supérieure à celle de
toute autre pile : au potentiel normal de 1,2 volt, on l’estime
à 25 ampères par décimètre carré
de zinc. Deux éléments semi-tubulaires en tension, produisent
l’incandescence blanche d’un tube de platine de 5 millimètres
de diamètre et 1/2 millimètre d’épaisseur,
ce qui répond à 150 ampères par 1,8 volt : ce groupe
pèse 10 kilogrammes. Une pile de 48 kilogrammes donne un cheval
de 736 watts.
La stabilité du liquide permet de le conserver quelques jours
: mais il se produit alors un dégagement de chlore. On l’atténue
en substituant, équivalent à équivalent, l’acide
sulfurique à l’acide chlorhydrique ; la capacité
du liquide ne diminue pas sensiblement.
La Pile Aron
C’est une adaptation nouvelle de la pile du commandant Renard,
que nous venons de décrire ; MM. Aron frères l’ont
modifiée dans le but de l’appliquer à l’éclairage
direct sans accumulateurs. Nous retrouvons le liquide excitateur chlorochromique
et les électrodes d’argent platiné. Les éléments
sont réunis dans un grand vase cylindrique en verre : les lames
d’argent et de zinc sont renfermées dans des tubes de verre,
qui plongent dans le liquide excitateur par leur extrémité
inférieure légèrement rétrécie ;
normalement le liquide ne baigne pas les lames. Mais une poire de caoutchouc
permet d’exercer une pression d’air dans le vase et de faire
monter le liquide dans les tubes ; la pile est dès lors en service.
Une vis permet de rétablir la pression atmosphérique en
débouchant une petite ouverture : le liquide baisse aussitôt
et la pile cesse de fonctionner.
Cette installation très ingénieuse et fort pratique, a
valu à MM. Aron frères une médaille d’argent.
La Pile Pillet
Le bichromate fait l’office de polarisant dans cette pile.
Les vases sont à deux étages ; leur partie inférieure
sert de réservoir au liquide, les lames de zinc et de charbon
occupent la partie supérieure. En déterminant une pression
d’air dans la cloche qui occupe le centre de l’élément,
on fait monter le liquide au niveau des électrodes et l’appareil
est à même de fonctionner Tous les éléments
semblables d’une pile étant reliés par des tuyaux,
on peut du même coup agir sur tous les vases, ce qui présente
de grandes facilités et paraît préférable
au soulèvement des lames par un treuil.
1866 La Pile Leclanché
Une pile Leclanché est un type de pile électrique
(cellule primaire) fonctionnant par oxydoréduction entre le zinc
et le dioxyde de manganèse, avec un électrolyte constitué
de chlorure de zinc et de chlorure d'ammonium.
Son principe est à l'origine des piles cylindriques
ou bâton. Sa force électromotrice vaut 1,5 V ; sa densité
d'énergie est de l'ordre de 0,18 W h cm-3, soit 650 kJ L. Après
une pile au carbonate de cuivre (CuCO3) brevetée 8 janvier 1866,
Georges Leclanché met au point en Belgique, en 1867, la première
pile au dioxyde de manganèse. Récompensée à
l'Exposition universelle de Paris la même année, elle est
rapidement utilisée par l'administration belge des télégraphes
et par les chemins de fer néerlandais.
Après 1871, Georges Leclanché fonde à Paris avec
Ernest Barbier la fabrique des piles Leclanché-Barbier, qui est
presque l'unique producteur de piles en France. En effet, la pile Leclanché
est la première pile à être fabriquée massivement
en grande série. Son fils et son frère améliorent
les performances de cette pile en travaillant sur l'immobilisation des
liquides (d'où le nom de "pile sèche").
En 1876, Leclanché gélifie l'électrolyte
de sa pile en ajoutant de l'amidon au chlorure d'ammonium. Cette modification
permet de rendre la pile transportable.


Ce sont des piles peu coûteuses à l'achat, mais qui - comme
les piles alcalines - sont à usage unique contrairement aux accumulateurs
électriques qui peuvent être rechargés. Elles peuvent
être employées dans des utilisations intermittentes ne
nécessitant pas une forte intensité : sonnerie,
télégraphe, téléphone puis
télécommande, réveil, poste de radio ...
 Bien avant que Victor
Hérold ne fonde la première usine de batteries alcalines
de France, Georges Leclanché avait créé la première
fabrique de piles sèches françaises à Paris, après
1871 et la fin du second Empire. Lorsqu’il meurt en 1882, il laisse
à son frère Maurice et à son fils une entreprise
florissante.
Bien avant que Victor
Hérold ne fonde la première usine de batteries alcalines
de France, Georges Leclanché avait créé la première
fabrique de piles sèches françaises à Paris, après
1871 et la fin du second Empire. Lorsqu’il meurt en 1882, il laisse
à son frère Maurice et à son fils une entreprise
florissante.
Le nom Leclanché est également utilisé par une
société suisse d'Yverdon (canton de Vaud) fondée
en 1909, qui a acquis en 2006 la société allemande Bullith,
devenue « Leclanché Lithium GmbH », basée
à Willstätt, toujours dans le domaine des piles.
En 1881, il en avait vendu plus de 300 000 ! Relativement petite et mobile, elle était utilisée pour alimenter des petits objets portatifs, comme les premières lampes torches, les horloges et surtout les téléphones.
En effet, avant que l’électricité
ne soit acheminée par les câbles téléphones
eux-mêmes, chaque téléphone avait besoin d’une
source d’énergie indépendante. La batterie était
cachée dans une boîte en bois à côté
du téléphone. Cependant, la batterie étant peu
puissante, les longues conversations finissaient souvent par être
inaudibles !

Les piles zinc-carbone et au chlorure de zinc sont deux
des piles primaires à base d’acide. Les piles zinc-carbone
existent depuis 1886, lorsque l'Allemand Dr Carl Gassner modifie
la pile Leclanché pour la rendre sèche en utilisant un
bloc comprimé de dioxyde de manganèse entouré par
une boîte de zinc qui agit comme l’anode. Pour l’électrolyte,
le Dr Gassner dissous le chlorure d’ammonium dans de l’eau
mélangé avec du plâtre de Paris pour créer
un gel. La pile zinc-carbone est devenue la première pile sèche
commercialisée en 1900 lorsque la société EverReady
a commencé à les vendre. Son succès fut immédiat
: en moins de deux ans, plus de 2000 exemplaires étaient déjà
utilisés pour les télégraphes.
Ce sont toujours les piles primaires les moins chères commercialisées
pour un usage général, cependant, elles fonctionnent mieux
pour un usage de faible consommation et pour des dispositifs à
usage intermittent, comme les télécommandes, les lampes
de poche ou les horloges. Les piles zinc-carbone en raison de leur prix
peu élevé sont encore largement utilisées comme
les piles qui sont offertes lors de l’achat de certains appareils.
En raison du caractère véritablement novateur de la pile
Leclanché, les clients potentiels doutent et la pile ne trouve
guère d’acheteur.
De plus, il n’a pas de brevet pour cette invention. C’est
au contraire Carl Gassner qui obtiendra un brevet fin 1887 pour
une pile similaire
En 1933, la « société des piles Leclanché
» passe un contrat avec la « société de l'accumulateur
Fulmen », pour la fabrication d'accumulateur au plomb. Mais de
nombreux concurrents apparaissent, dont Wonder en France et l'entreprise
périclite.


Elle change plusieurs fois de mains, passe sous le giron de la société
Fulmen et se fond finalement dans le groupe CGE.
En 1938, Fulmen acheta à Chasseneuil-du-Poitou un ancien abattoir,
transformé en fabrique de charcuterie, pour en faire une usine
de petit matériel électrique. Des piles électriques
y sont aussi fabriquées, sous la marque Leclanché. C’est
cette usine qui est ensuite reprise par Saft en 1952. Saft et Fulmen
appartenaient alors toutes deux à la Compagnie Générale
d’Electricité (CGE).
Dans les années cinquante, l’usine de Chasseneuil-du-Poitou
a employé jusqu’à un millier de salariés pour
fabriquer ces piles sèches dont les usages étaient en
train de se démultiplier. L’usine était un pôle
industriel important dans cette région rurale et attirait nombre
de jeunes de la région, parfois par familles entières.
On appelait alors cette usine « Leclanché », tout
simplement, ou encore « La Pile ».


Saft continua la production de piles grand public jusqu’à
la reprise de cette activité par Bernard Tapie. Entretemps, en
1965, l’usine de Chasseneuil et sa production avaient été
transférées non loin, à Poitiers. L’adresse
de cette usine est … avenue Georges-Leclanché !
L’élément Binder n’est
qu’une modification de la pile Léclanché. Il se compose
d’un vase cylindrique, qui porte, à peu près vers
son milieu, une saillie, servant d’appui à un cylindre de
zinc, creux. Au centre du vase, se trouve un crayon de charbon, que
l’on entoure d’un mélange de bioxyde de manganèse
et de charbon, jusqu’à la hauteur de la saillie. Un couvercle
percé de deux ouvertures par lesquelles passent les électrodes
empêche l’évaporation de la solution de chlorhydrate
d’ammoniaque.
Gaiffe a modifié la pile Léclanché en remplaçant
le chlorhydrate d’ammoniaque par du chlorure de zinc à 45°
B. Le courant résulte de l’oxydation du zinc aux dépens
du bioxyde de manganèse, qui passe à l’état
de sesquioxyde. L’oxychlorure de zinc étant soluble dans
le chlorure de zinc, l’action n’est pas arrêtée.
La force électromotrice du couple équivaut à un
couple et demi de Daniell. Sa constance est assez grande, et sa polarisation
très lente ; elle disparaît même lorsqu’on laisse
quelque temps la pile en repos.
 pile de Gaiffe au chlorure
de zinc
pile de Gaiffe au chlorure
de zinc
Le charbon est prismatique ; mais il est percé, dans le sens
de sa longueur, de 4 trous, dans lesquels on place le bioxyde de manganèse,
en le tassant légèrement ; ce qui a pour effet de supprimer
le vase poreux, tout en diminuant la résistance électrique.
Ces trous servent à retirer le produit résultant de la
réaction chimique qui a engendré l’électricité.
Le vase de verre qui contient le charbon est carré, et fermé
par un bouchon luté à la cire, et présentant seulement
un trou, qui sert à introduire le liquide dans le vase, et à
faire pénétrer le bâton de zinc.
La force électro-motrice de la pile au chlorure de zinc, de Gaiffe,
est inférieure à celle de la pile Léclanché.
Pour éviter la décroissance rapide qu’éprouve
la force électro-motrice des piles au bioxyde de manganèse,
M. Devos a construit un couple dans lequel le vase poreux est
supprimé, et où l’élément dépolarisateur
et l’élément actif sont mélangés autour
du conducteur positif. Ce dernier consiste en une lame de charbon, qui
divise la pile en deux parties : d’un côté est le
zinc et le bioxyde de manganèse, de l’autre, un mélange
de chlorhydrate d’ammoniaque et de coke concassé. On charge
le couple avec de l’eau pure, qui dissout le sel ammoniac et met
la pile en activité. Le zinc se transforme en chlorure, et le
graphite joue le rôle de dépolarisateur mécanique.
MM. Leroux et Guiguet ont obtenu des piles à courant intense,
en substituant à l’acide azotique de la pile Archereau,
du bioxyde de manganèse, et en remplaçant l’acide
sulfurique par de l’acide chlorhydrique étendu d’eau.
M. Edredge a fait une pile au protoxyde de plomb, que l’on
dit être très constante, et qui est formée d’un
vase au fond duquel est placée une plaque de plomb, constituant
le conducteur positif. Au-dessus, se trouve la litharge, puis de l’eau
salée, dans laquelle plonge le conducteur négatif. Celui-ci
consiste en une lame de zinc amalgamé, suspendue, par trois agrafes,
au vase de la pile. L’action est la suivante : l’hydrogène,
dégagé par l’attaque du zinc, réduit la litharge,
qui se dépose à l’état métallique sur
la lame de plomb.
MM. Clamond et Gaiffe ont substitué au bioxyde de manganèse
de la pile Léclanché le sesquioxyde de fer. Le défaut
de cette pile est d’offrir une énorme résistance
intérieure ; en revanche elle est impolarisable, et ne s’use
que quand son circuit est fermé.
M. Reynier a construit une pile dont le vase poreux, constitué
par du papier-parchemin, renferme du cuivre métallique et du
sulfate de cuivre. Autour est une solution concentrée de soude
caustique. Le principal avantage de cette pile réside dans son
peu de résistance, qui lui donne une intensité considérable.
Avec moins de 30 éléments on peut produire l’incandescence
d’une lampe électrique Swam ou Edison.
M. Desruelles a construit des piles Daniell et Léclanché
qu’il a rendues facilement transportables en entourant le vase
poreux d’amiante imbibée de la solution excitatrice.

Ces piles, analogues à celle que Zamboni proposa, en 1812, ne sont applicables que pour les actions discontinues, parce que le liquide, étant immobilisé, ne peut reprendre son homogénéité que par diffusion à travers l’amiante.
MM. de Lalande et Chaperon ont imaginé
de construire, avec l’oxyde de cuivre et la potasse, une pile à
un seul liquide et à dépolarisant solide, qui constitue
un générateur électrique constant, simple, économique,
et ne consommant les matières actives qu’en proportion du
travail fourni.
L’oxyde de cuivre est un des oxydes qui abandonnent le plus facilement
l’oxygène, et ce composé a encore l’avantage
de donner, après sa réduction, un métal très
bon conducteur de l’électricité. C’est cet oxyde
que MM. Lalande et Chaperon emploient comme dépolarisant, en
le mettant en contact avec une surface métallique dont le prolongement
constitue l’électrode négative.
L’électrode positive est une tige à lame de zinc,
plongeant dans une solution de potasse caustique à 30 ou 40 p.
100, qui sert de liquide excitateur.
Pile Lalande et Chaperon (modèle en spirale)
Un dernier modèle, que les inventeurs appellent modèle
en spirale.
 — .L’élément
à spirale à couvercle mobile est formé d’un
vase cylindrique en verre, V, contenant :
— .L’élément
à spirale à couvercle mobile est formé d’un
vase cylindrique en verre, V, contenant :
1° Une boîte en tôle, A, pouvant servir à transporter
la potasse caustique, et destinée à recevoir l’oxyde
de cuivre lorsque la pile est montée.
2° Un zinc amalgamé, D, contourné en spirale et qu’un
écrou, F, servant de borne, fixe au couvercle mobile. Un tube
de caoutchouc, C, protège le zinc, qui a toujours une tendance
à se casser au niveau du liquide excitateur.
3° Une tige de cuivre, G, isolée par un tube de caoutchouc
et traversant le couvercle. Cette tige est fixée, à sa
partie inférieure, à la boîte A, et constitue le
pôle positif de l’élément.
Pour mettre cet élément en service, on retire la boîte
de tôle, pour la charger d’oxyde, puis on la replace au fond
du vase, que l’on remplit ensuite avec la solution de potasse.
Lorsque le liquide est devenu clair, on remet le couvercle, en ayant
soin que le caoutchouc qui entoure la tige de cuivre l’isole bien
du zinc.
L’élément à spirale se recommande spécialement
pour la charge des accumulateurs.
Pile de Lalande et Chaperon (élément à auge).
La deuxième forme de ces éléments est le modèle
à grande surface, dit modèle à auge. Il se compose
d’une auge A, en tôle de fer, dont le fond est garni d’une
couche d’oxyde de cuivre. Sur cette couche est étendue une
feuille de papier-parchemin, sur laquelle reposent, aux quatre coins,
les supports isolateurs L, devant porter la plaque de zinc amalgamé,
D.
Sur l’auge même est fixée la borne C, du pôle
positif ; celle du pôle négatif, M, est attachée
à une lame de cuivre rivée au zinc.
L’élément à auge s’emploie pour la galvanoplastie,
la charge des accumulateurs et la lumière électrique.
Deux éléments, grand modèle, équivalent
à un élément Bunsen de 0m,20 de hauteur.
M. d’Arsonval, qui a expérimenté à plusieurs
reprises l’élément à auge de MM. de Lalande
et Chaperon, s’exprime ainsi dans la Lumière électrique
du 25 août 1883 :
« Un kilogramme d’accumulateurs dépose 20 grammes
de cuivre, tandis que 1 kilogramme de pile Lalande-Chaperon dépose
100 grammes. La quantité de coulombs donnée par la pile
est donc 5 fois plus grande que celle qui est fournie par l’accumulateur
du même poids.
Quant au travail électrique, la pile Lalande-Chaperon, à
poids égal, vaut deux accumulateurs Planté, bien formés
comme quantité d’énergie emmagasinée. J’ai
souvent pesé le zinc, après avoir fait donner à
la pile un travail connu ; toujours la consommation a été
à très peu près égale à celle qui
est indiquée par la théorie. Ce fait prouve, par conséquent,
que ce couple est exempt de réactions secondaires et ne consomme
qu’en proportion du travail fourni.
Les essais de M. Hospitalier rapportés dans l’Électricien
du 1er août 1882 ont donné les résultats suivants
:
La pile dont la face électro-motrice initiale, une heure après
le montage, était de 0,98 volts, a été mise en
circuit pendant six jours entiers sur une résistance au fil de
maillechort de 0,8 ohm.
Le courant fourni a été, en moyenne, d’un demi-ampère
pendant six jours en 518 400 secondes. La quantité totale d’électricité
fournie a été de 259 000 coulombs, le poids de zinc consommé
de 88 grammes, ce qui correspond à une production théorique
de 260 000 coulombs ; c’est là un point des plus importants,
très favorable à la pile de MM. de Lalande et Chaperon,
car il montre que la consommation est théorique, c’est-à-dire
que l’action locale est pratiquement nulle. L’énergie
que la pile est susceptible de fournir est donc disponible à
volonté par fractions quelconques, sans qu’on soit obligé
de toucher aux éléments pour retirer le zinc du liquide.»
La constance remarquable du débit doit être surtout attribuée
à ce que le produit de la réduction est du cuivre métallique
bon conducteur. »
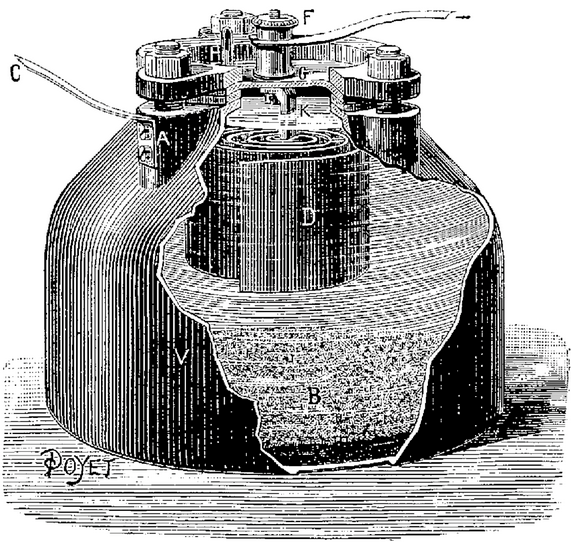 —
Pile de Lalande et Chaperon (élément en obus).
—
Pile de Lalande et Chaperon (élément en obus).
MM. de Lalande et Chaperon ont donné à leur élément
une autre disposition, très avantageuse, qui le rend facilement
transportable, et lui donne une très grande solidité.
Nous voulons parler du modèle en obus représenté
ici. Le vase extérieur, au lieu d’être en verre, est
formé par une sorte de bouteille en fonte, qui constitue le pôle
positif de l’élément. Un tenon, A, sert à
fixer la lame A C, formant électrode. Le vase V est paraffiné
à chaud, pour empêcher les dérivations et afin de
le rendre inoxydable. Une tige de laiton amalgamé K, terminée
par la borne F, est fixée au bouchon de caoutchouc, C, et porte
un gros cylindre de zinc amalgamé, D. Enfin, une soupape H, formée
d’un bout de tube en caoutchouc fendu à sa partie supérieure,
termine un petit tube métallique qui traverse le bouchon F.
L’élément en obus est surtout employé pour
les téléphones et les sonneries d’appartements.
Il en existe un modèle à grande surface qui peut donner
un débit allant jusqu’à dix ampères, et s’emploie
aux mêmes usages que les éléments Bunsen ou à
bichromate de potasse.
La pile à oxyde de cuivre de MM. de Lalande et Chaperon a l’avantage
d’être d’une grande surface et de ne produire aucune
émanation pénible. Aucune réaction ne se produit
tant que le circuit est ouvert. Quand le courant est fermé, le
zinc se dissout dans la potasse, en formant du zincate de potasse, et
le gaz hydrogène qui se dégage réduit l’oxyde
de cuivre.
Ce dernier peut être ramené à l’état
d’oxyde, en le chauffant au rouge, et il peut servir à de
nouvelles opérations.
La Pile Perreur-Lloyd et fils
On brûle du zinc dans les piles pour obtenir un courant ;
la dépense de zinc est le prix de l’énergie électrique
engendrée, mais ce mode de production est coûteux, car
le résidu de l’opération n’a pas de valeur.
Ne pourrait-on pas obtenir aussi bien un courant en brûlant un
métal qui produirait un sel possédant une valeur vénale
? C’est le problème que M. Perreur a résolu.
Il brûle du cuivre en l’attaquant par un liquide excitateur
composé d’acide sulfurique et d’acide azotique ; il
recueille le sulfate de cuivre résultant de la réaction
et condense les vapeurs nitreuses.Pour réduire encore la dépense,
l’opération est conduite de telle façon que le liquide
excitateur épuisé soit de nouveau utilisable comme liquide
dépolarisant. Bref, il se perd le moins de substances que possible.
Comme les électrodes solubles peuvent être constituées
de déchets qu’on achète à bas prix, et que
les sels sont obtenus sous la forme la mieux appropriée pour
en faciliter la vente, on arrive à engendrer l’électricité
d’une façon relativement économique. Yoilà
vraiment la pile de l’avenir.
MM. Perreur-Lloyd et fils ont adopté le type de la pile de Bunsen
à électrodes de charbon et de cuivre ; le liquide excitateur
est un mélange de trois équivalents d’acide sulfurique
pour un équivalent d’acide nitrique dans un état
de concentration déterminé pour attaquer le cuivre ; quand
l’acide est en partie neutralisé, on y mélange un
volume d’acide sulfurique pour le faire servir de dépolarisant.
On active les réactions en chauffant la pile par un courant de
vapeur. Les résidus sont dirigés vers des cuves de cristallisation.
Le dispositif des éléments est très rationnel,
mais un peu compliqué ; cet inconvénient est amplement
compensé par les résultats, qu’il était impossible
d’obtenir plus simplement. On transforme la pile en un appareil
qu’on appellerait avec plus de raison chimico-électrique
qu’électro-chimique, car le produit est une substance chimique
alors que l’électricité n’est qu’un sous-produit.
Ainsi on a transformé de vieilles rognures de laiton en sulfate
de cuivre et en sulfate de zinc, lequel a encore servi à la fabrication
d’ammoniaque et de blanc de zinc.
Le même procédé pourrait conduire à la formation
d’autres sels dont la vente serait encore plus productive.
La Pile Bablon
M. Bablon a inventé un commutateur automatique, pour le chargement
des accumulateurs qui lui a valu une mention honorable : cet appareil
permet de charger un groupe d’accumulateurs montés en tension
par une source de force électromotrice moindre, en prenant les
pôles du générateur primaire et en les portant successivement
sur les pôles de chaque accumulateur et en répétant
cette opération à tour de rôle sur chacun d’eux.
L’idée est ancienne déjà et elle avait appliquée
autrefois par M. Thomsen, de Copenhague, à la charge d’une
batterie de piles à gaz : mais le dispositif de M. Bablon est
nouveau et ingénieux. Il a adopté à son projet
une sorte de cylindre d’orgue de Barbarie disposé au-dessus
d’un clavier mettant tour à tour en contact les pôles
des piles primaires et secondaires : ce cylindre peut être mû
par un poids, un ressort ou bien un petit moteur électrique.
La Pile Semn
Prenez un bloc de bois imperméabilisé, et creusez
à la suite l’une de l’autre un certain nombre de cavités,
dans lequel vous logerez un zinc et un charbon baignant dans un liquide
acide, puis fermez hermétiquement les ouvertures. Vous formez
ainsi une pile, qui pourra fonctionner très longtemps et actionnera
sans défaillance des allumoirs de tout genre. Nous venons de
décrire la pile de M. H. Serrin, récompensée par
une mention honorable.
La Pile O’Keenann
M. O’Keenann a complètement transformé la pile
de Daniell en rendant son fonctionnement automatique, de sorte qu’on
n’ait plus à en démonter les éléments
pour assurer leur entretien : ce résultat est obtenu par un ingénieux
mode de distribution et de renouvellement des liquides.
Nous retrouvons dans cette pile, le zinc, au pôle négatif,
baignant dans le sulfate de zinc ; des lames de plomb cuivré
forment l’électrode positive, plongée dans le sulfate
de cuivre. C’est donc une pile de Daniell. Mais la lame de zinc
est entourée d’un fourreau de papier parcheminé,
ouvert en haut et en bas, et elle occupe la partie centrale de l’élément
; ce fourreau forme un vase poreux sans fond.
Le liquide de la pile est constitué par trois couches distinctes,
superposées par ordre de densité : il y a du sulfate de
zinc au fond du vase et dans le fourreau central ; au-dessus, se trouve
une solution de sulfate de cuivre surmontée d’une couche
d’eau pure. Le fonctionnement de la pile produit du sulfate de
zinc qu’il faut éliminer ; le sulfate de cuivre doit être
maintenue à saturation et l’eau pure consommée doit
être renouvelée pour assurer la marche des réactions.
Voyons comment M. O’Keenann réalise ces diverses conditions
: il est arrivé après quelques tâtonnements à
un. dispositif simple, pratique, voire même élégant
; du reste, tout ce qui est simple et pratique devient facilement élégant.
L’eau pure arrive à la partie supérieure de la pile
goutte à goutte, en s’écoulant d’un réservoir
élevé ; le robinet de débit en donne un excès
qui surnage en vertu de sa moindre densité et dont on se débarrasse
par un déversoir de trop plein.
Une trémie renferme les cristaux de sulfate de cuivre et les
fait tomber dans la pile au fur et à mesure de leur dissolution
: la partie moyenne du liquide est donc maintenue à saturation.
Le sulfate de zinc formé s’accumule au fond des vases :
il est évacué par un tuyau de descente, partant du niveau
supérieur qu’on lui permet d’atteindre et débouchant
dans un godet de mercure. L’extrémité du tuyau est
donc immergée dans le mercure, et les colonnes de sulfate de
zinc dans le tuyau et de mercure autour de ce tuyau se font équilibre.
Si le niveau du sulfate s’élève dans la pile, cet
équilibre est rompu et ce liquide s’écoule en traversant
le mercure. Il n’y a donc à régler, une fois pour
toutes, que l’arrivée d’eau et la hauteur du mercure
dans le godet.
M. O’Keenann réunit dix éléments dans une
caisse à parois de verre ; des planchettes de sapin paraffiné
forment cloison entre eux.
On dispose les accumulateurs, qu’on veut charger au-dessous de
la pile.
D’après M. Hospitalier, qui a rendu compte de cette pile
dans l'Électricien, cette pile peut fonctionner plusieurs mois
sans être démontée et sa conduite peut être
confiée au premier venu. Nous avons cherché en vain le
nom de M. O’Keenann sur la liste des récompenses : nous
pensions l’y trouver.
La Pile Yoltagène Paillard
M. Paillard désigne sous le nom de voltagène une pile
de Daniell modifiée, à alimentation continue et automatique.
La modification de l’élément porte sur le zinc, qui
est entouré d’une composition adhérente, perméable
au liquide ; de plus, le plomb gondolé et percé de trous
remplace la lame classique de cuivre.
Le sulfate de cuivre est débité par un grand réservoir,
muni d’une soupape à réglage électrique, commandée
par un électro-aimant monté en dérivation sur le
circuit ; plus le courant est intense, plus la soupape est levée,
de telle sorte que l’alimentation soit toujours proportionnelle
'au travail demandé à la pile. Le liquide tombe dans un
distributeur à siphon intermittent, qui dessert tous ies éléments
par une longue gouttière.
L’extraction du sulfate de zinc produit et accumulé au fond
de la pile se fait par un siphon à mèche, qui ne s’amorce
que lorsque le liquide atteint dans la pile un niveau déterminé.
La Pile Grendron
M. Grendron a obtenu une médaille de bronze pour l’ingénieux
système de distribution qu’il a su réaliser. Sa pile
est l’élément classique de Poggendorff dont l’excitation
est faite par l’eau acidulée et la dépolarisation
par un bichromate alcalin : de ce côté rien de nouveau.
Mais la disposition des éléments est tout à fait
différente de ce qu’on faisait jusqu’ici.
Le vase poreux a une forme sinueuse : il se replie six fois sur lui-même
et renferme six électrodes de zinc; sa largeur est de 25 millimètres
au plus. C’est donc un canal sinusoïdal dans lequel circule
de l’eau acidulée. Entre ses replis sont logées six
plaques de charbon : le liquide chromique circule le long des parois
du vase et en suit tous les contours, attendu que les charbons qui sont
encastrés par une extrémité dans la paroi de la
caisse dessinent un canal parallèle à la surface de terre
poreuse. Les liquides lavent donc les électrodes et cette circulation
produit les meilleurs résultats.
De grands vases distributeurs alimentent les piles, disposées
sur des rayons d’un meuble analogue à une bibliothèque
: après leur parcours, les liquides sont évacués
par des robinets spéciaux. Leurs boisseaux sont des cylindres
allongés, ayant toute la hauteur de l’élément
; l’eau acidulée, chargée de sulfate de zinc, est
prise à la partie inférieure, remonte dans le noyau et
s’écoule par un trou. En tournant le boisseau, on peut opérer
une vidange complète et mettre les vases à sec. Ûn
robinet du même genre évacue goutte à goutte le
bichromate épuisé.
On a constaté que cette pile peut fonctionner une quarantaine
d’heures : une batterie peut donc être appliquée à
l’éclairage domestique, et, grâce à une pompe
et à une heureuse disposition de l’ensemble, la manipulation
en est extrêmement aisée.
La Pile Lagarde
L’inventeur a cherché à créer une pile
domestique : c’est une pile au bichromate, à un seul liquide,
dont les électrodes peuvent être manœuvrées
à distance : à cet effet, elles sont toutes fixées
à une couronne, attachée elle-même à l’extrémité
d’un grand fléau de fer équilibré, qu’on
peut faire basculer autour de son centre d’oscillation, en agissant
sur un renvoi de mouvement, dont la forme change avec la disposition
des lieux.
La couronne sert de support aux zincs et aux charbons : ces électrodes
sont de grandes lames de 200 millimètres de longueur sur 130
millimètres de largeur; elles sont percées de troüs.
M. Lagarde les dispose radialement, et leur groupe ment en tension est
obtenu au moyen de lames de cuivre encastrées dans l’épais
seur de la couronne. La cuve est divisée en autant de compartiments
qu’il y a de paires d’électrodes, munis chacun d’un
siphon qui remonte le liquide épuisé et le rejette au
dehors : le liquide neuf, débité par un réservoir
supérieur, est conduit aux compartiments par un distributeur
à rigoles de plomb.
La Pile Arnould
Une pile de 12 éléments peut alimenter 25 bougies
: son rendement le plus avantageux correspond à une intensité
de 5 ampères par 15 volts.
Les qualités de la pile Lagarde ont été reconnues
par une médaille de bronze.
Le pôle positif de cette pile est formé de fragments de
coke, sur lesquels le contact s’opère par une large feuille
de plomb, qui double le vase de l’élément ; c’est
un moyen ingénieux de réduire la résistance ; un
liquide chromique baigne le coke. Le zinc et l’eau acidulée
sont renfermés dans le vase poreux central.
L’alimentation se fait encore en dérivation : le liquide
est fourni par un récipient de grande capacité dont le
débit est réglé par un robinet. Ce récipient
est clos, et le liquide ne peut s’en écouler qu’à
la condition d’y faire rentrer de l’air bulle pour goutte
: or, la rentrée de l’air est réglée par le
courant lui-même. En effet, un électro-aimant, animé
par une dérivation du courant, forme un e soupape quand l’intensité
est supérieure à la normale, tandis qu’elle l’ouvre
largement aussitôt que l’intensité diminue : on se
rend facilement compte de ce dispositif.
La Pile de Mare & Besnier
Le liquide de cette pile est obtenu en dissolvant du bichromate
d’ammoniaque dans de l’eau fortement acidulée par de
l’acide sulfurique ; cette dissolution remplit le double rôle
d’excitateur et de dépolarisant, et elle est caractérisée
par une capacité considérable, ce qui en recommande l’emploi.
L’électrode conductrice est en charbon ; l’électrode
soluble est constituée par de la grenaille de zinc noyée
dans le mercure, ce qui entretient une richesse constante d’amalgame,
attendu que le zinc se dissout dans le mercure à mesure qu’il
se consume dans la pile. Le brevet de Mare signale aussi la possibilité
de l’emploi d’un amalgame de sodium.
La caisse de la pile est formée d’une double série
de lames de charbon enchâssées dans les rainures d’un
cadre de bois imperméabilisé. Les plaques extrêmes
sont enivrées ; l’intervalle des doubles lames est rempli
de coke concassé. Des couvercles hermétiques ferment la
caisse. La grenaille de zinc est renfermée dans une cuvette de
terre poreuse.
Cette pile est à écoulement. Le liquide est débité
goutte à goutte par un ingénieux distributeur, qui débouche
à la partie supérieure de la caisse étanche, et
il traverse la pile pour s’écouler par la partie inférieure
; il s’échappe par un siphon.
La distribution du liquide se fait par dérivation et c’est
peut être le caractère le plus original de ce dispositif
: c’est pourquoi nous jugeons nécessaire de le décrire
complètement. Le liquide est renfermé dans une grande
bouteille, munie d’un tuyau latéral d’écoulement
à robinet ; un tube de verre deux fois recourbé part du
bouchon et vient aboutir à côté de l’orifice
du tuyau d’écoulement. Ce tuyau et le tube débouchent
dans une ampoule de verre placée au-dessus de la pile. Ce robinet
étant ouvert, le liquide remplit l’ampoule ; bientôt
le tube est noyé, et alors la pression diminue dans la bouteille,
puisque l’air n’y pénètre plus ; l’écoulement
cesse donc, mais il reprendra dès que, le liquide ayant baissé
dans l’ampoule, l’extrémité du tube d’air
sera de nouveau dégagée. On obtient ainsi un écoulement
constant, sous l’influence d’une différence de pression
constante.
La pile de Mare convient aussi bien à l’éclairage
direct qu’à la charge des accumulateurs.
La Pile Sappey
Cet élément est exposé par l'Automatic Electrical
corporation : il reproduit le type Poggendorff, mais présente
quelques modifications dans la disposition relative des électrodes.
Le zinc et l’eau acidulée sont à l’extérieur,
tandis que le vase poreux renfermant le charbon et le bichromate occupe
le centre ; le vase poreux est double, et les charbons forment un faisceau,
ce qui diminue la résistance intérieure.
Cette pile n’est plus à circulation, mais à renouvellement
total des liquides épuisés ; au bout d’un temps déterminé,
la pile est vidée et rechargée, cette opération
se faisant automatiquement, de la manière suivante. Le dispositif
est le même pour les deux liquides, et nous n’aurons qu’une
description à en donner.
Le liquide est débité par une soupape et évacué
par une autre, commandées toutes deux par un appareil électrique
mis en jeu périodiquement par une horloge. La première
soupape déverse le liquide d’un réservoir dans un
bac intermédiaire en plomb, muni d’un siphon qui ne s’amorcera
que lorsque le liquide aura atteint un certain niveau. A ce moment,
le liquide se déverse dans une rigole de distribution en faisant
mouvoir un basculeur dont nous verrons tout à l’heure le
rôle .
Le liquide est amené par une canalisation aux éléments
dans lesquels il pénètre par le fond ou par le côté.
L’évacuation a lieu quand la même horloge ouvre la
soupape de vidange. Yoici comment se font simultanément ces deux
opérations: à l’heure voulue, l’horloge fait
ouvrir les deux soupapes; la soupape de vidange étant plus grande
que celle d’alimentation, la purge est achevée avant que
le bac intermédiaire ne soit rempli et que le siphon n’ait
fonctionné ; le bas-culeur rompt le circuit en se renversant,
et les deux soupapes se ferment, de sorte que le remplissage de l’élément
se fait alors par le débit du siphon. Il est donc impossible
que le liquide passe directement à la vidange : ce système
est extrêmement ingénieux et vraiment remarquable. Le bichromate
est renouvelé toutes les trois heures, alors que l’eau acidulée
reste en service plus de 12 heures. Les tuyaux de la canalisation pourraient
créer des dérivations du courant ; on les évite
en intercalant des portions isolantes de tubes de verre.
On a appliqué très heureusement la pile Sappey à
la charge des accumulateurs.
La Pile Kornfeld
Un des défauts les plus ordinaires des piles, c’est
d’être encombrantes. M. Kornfeld a réussi à
réduire leur volume au minimum.
A cet effet, il emploie des vases plats en charbon, cuivrés à
l’extérieur, dans lesquels peuvent descendre des lames de
zinc assemblées parallèlement et formant un châssis
de 40 plaques, qui vont glisser dans des coulisseaux et qu’on manœuvre
à l’aide d’un treuil.
Les liquides se distribuent par deux séries de tuyaux d’alimentation
et d’évacuation, dont on règle le débit par
des robinets.
Une batterie de 40 éléments, d’une puissance de 750
watts, occupe une surface de 90 décimètres carrés.
C’est une pile chromique.
1881 Camille Alphonse Faure 1840 est un ingénieur
chimiste français qui a, de façon significative, amélioré
le design de la batterie inventée par Planté 1859. Les
améliorations de Faure ont beaucoup augmenté la capacité
de la batterie et ont mené directement à sa fabrication
sur une échelle industrielle. En 1880, Faure fit breveter une
méthode pour enrober les plaques de plomb avec une pâte
faite de plomb oxydé, d'acide sulfurique et d'eau. Les plaques
étaient ensuite séchées et doucement réchauffées
dans une atmosphère humide. Lors du séchage la pâte
se changeait en une mixture de sulfates de plomb, qui adhérait
à la plaque de plomb.
Le grand scientifique anglais, Sir William Thomson, fut fou d'enthousiasme
lorsqu'on lui apporta de Paris une « boîte d'électricité
» Faure contenant un million de pieds-livres d'énergie
stockée. Son biographe, le Dr Sylvanus P. Thompson, le décrit
alité, malade, avec une jambe blessée, observant les résultats
avec une lampe à incandescence fixée au rideau de son
lit par une épingle de sûreté et éclairée
par le courant de la petite pile Faure. Sir William déclara :
« Ce sera une invention extrêmement précieuse
et pratique, aussi précieuse que les citernes d'eau pour les
gens, qu'ils aient ou non des systèmes de canalisations et d'approvisionnement
en eau. » En effet, dans un élan de louange, le physicien
avisé remarqua qu'il y voyait « la concrétisation
de l'aspiration scientifique la plus ardente et la plus profonde de
sa vie – une aspiration qu'il osait à peine espérer
ou voir se réaliser. » Un peu plus tard, cependant, Sir
William, toujours prudent et rusé, commença à découvrir
les défauts inhérents à la batterie primitive,
tels que la désintégration, l'inefficacité, le
coût, etc., et, malgré des incitations alléchantes,
refusa de prêter son nom à son introduction financière.
Il accepta néanmoins le principe comme valable et mit la batterie
en pratique.
En 1881 Le Bureau international des poids et
mesures choisit de nommer l'unité de potentiel électrique
le « volt », en référence à
Volta.
La pile Volta permet de nouvelles avancées sur l’électricité,
comme l’hydrolyse et les batteries.
Avec cette pile énorme et puissante, les physiciens et les chimistes
français, Gay-Lussac, Thénard, Ampère, Arago et
bien d'autres purent à leur tour travailler et faire de grandes
découvertes. Il en alla de même en Angleterre où
la pile créée par la " Royal Institution " de
Londres atteignit 800 cellules.
Le 19 Avril 1881, Gustave Trouvé
fait circuler à Paris, rue de Valois un tricycle doté
de batteries et d'un moteur électrique.

Trouvé met en place un atelier dans le centre de Paris, où
il brevette de nombreuses applications très diverses dans le
domaine de l'électricité, inventions décrites régulièrement
par les magazines de vulgarisation scientifique de l'époque telles
que La Nature. Pour alimenter ses automates électriques miniatures,
il invente une batterie de poche carbone-zinc qui devient rapidement
très populaire. Une batterie similaire a été inventée
et largement commercialisée par Georges Leclanché.
La Pile Radiguet
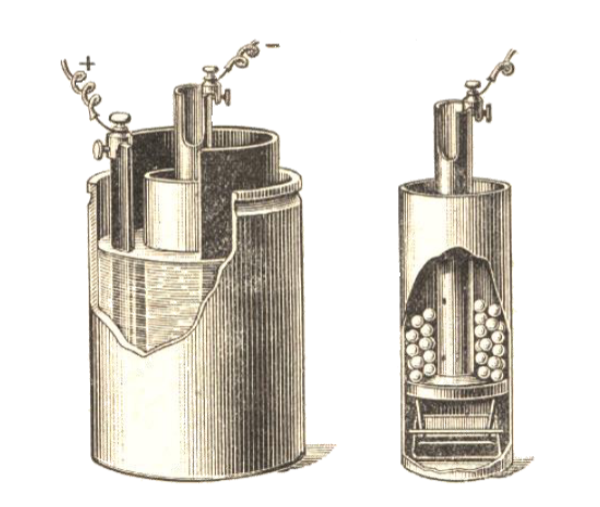

C'est une pile à deux électrolytes : eau acidulée
et bichromate de potassium
Elle dispose d'un support à amalgamer qui permet de supprimer
le relevage de l'électrode en zinc. Ce dispositif entretient
la couche de mercure à la surface du zinc. De plus il permet
d'utiliser des déchets de ce métal (rognures ou billes
de zinc) que l'on introduit périodiquement dans la pile comme
on met du charbon dans un fourneau.Une telle pile avec une fem d'environ
2,1 V est capable de débiter plus de 1 Ampère .

La maison Radiguet a acquis une juste
notoriété par les heureuses dispositions qu’elle
a données à la pile de Poggendorff : elle a obtenu une
médaille d’argent. Les éléments Radiguet sont
constitués par 4 lames de charbon qui entourent le vase poreux
renfermant le zinc : on en forme des batteries en les groupant en deux
rangées parallèles, surmontées d’un treuil
pour le relèvement des zincs.
Un modèle, dit à bascule, a obtenu un légitime
succès, car il permet non-seulement de retirer le zinc de l’eau
acidulée, mais encore d’isoler le bichromate du liquide
excitateur, ce qui est avantageux, car on sait que les liquides se mêlent
à travers la paroi des vases poreux. Pour cela, ces vases ont
reçu la forme d’un cœur à deux lobes très
découpés, de façon à former deux vases distincts
situés à angle droit l’un par rapporta l’autre:
un des lobes est perméable, l’autre est émaillé,
donc rendu imperméable. Le premier trempe dans le bichromate
quand l’élément est en service ; l’autre est
en l’air.4 mais à l’état de repos, on fait basculer
le cœur, de manière à retirer la portion poreuse
du liquide : le zinc suit ce mouvement et l’eau acidulée
se déverse dans le lobe émaillé. D’une main,
on fait mouvoir tous les éléments d’une batterie
: ce dispositif assure une durée beaucoup plus grande des zincs
et des liquides.


M. Radiguet a créé
un autre modèle de pile qui est réellement pratique :
c’est une pile domestique.


Les éléments qui la composent sont placés sur une
cuve en bois garnie de plomb ou vernie au bitume de Judée ; elle
forme gouttière et a un écoulement au dehors. Chaque élément
est composé sur le type de Poggendorff, mais le charbon est au
dehors du vase poreux et le zinc à l’intérieur. Le
charbon a la forme d’un cylindre ; le zinc est à l’état
de rognures ou de déchets, contenus dans un appareil spécial,
appelé par l’inventeur le support à amalgamer. Cet
appareil se compose d’un tube en cuivre rouge portant à
sa base une sorte de corbeille destinée à recevoir les
fragments de zinc ; sous cette corbeille est suspendue, par deux tiges
de cuivre, une cuvette remplie d’un amalgame tenant un peu de zinc
en dissolution. Par une action que M. Radiguet croit électrique,
mais qui pourrait être capillaire, le mercure grimpe le long du
support et maintient le zinc de la corbeille dans un parfait état
d’amalgamation, pendant plusieurs mois. La manipulation des liquides
se fait à l’aide d’un siphon, qu’on amorce en
soufflant et qu’on désamorce aussi en soufflant, sans avoir
à boucher la branche d’écoulement : on peut souffler
à la bouche ou employer une poire en caoutchouc. Grâce
à ce siphon, on renouvelle à volonté les liquides,
qui tombent sur la table à gouttière et sont évacués
au dehors. Tout est ingénieux dans cette pile, qui donne du reste
d’excellents résultats. Nous signalerons encore la Pile
Tommasi et Radiguet.
La Pile Tommasi et Radiguet
Au centre d’un vase de verre cylindrique se trouve un bâton
de charbon recouvert d’une couche épaisse de peroxyde de
plomb (PbO2), et le tout est renfermé dans un sac en toile .

Cette électrode, ainsi enveloppée, est placée
dans un tube de charbon percé de trous ; le tout est mis dans
un vase de verre rempli de fragments de charbon de cornue et d’une
solution concentrée de chlorure de sodium additionnée
de chlorure de calcium ; le niveau de cette solution ne doit pas dépasser
le milieu du vase de verre. Les fragments de charbon qui ne sont pas
mouillés sont recouverts d’une couche de chlorure de calcium.
Cette pile, dont la f. c. m. est de 0,6 à 0,7 volt, ne travaille
qu’en circuit fermé.
Comme elle se polarise rapidement, elle ne convient que pour les applications
qui réclament un courant intermittent.
1885 La Pile à oxyde de cuivre de Lalande
et Chaperon
Cette pile utilise comme "liquide excitateur" (nous disons
électrolyte de nos jours) une solution de potasse à 30
ou 40 %.
Le dépolarisant est de l'oxyde de cuivre qui peut être
sous forme de poudre ou de briquette de poudre comprimée.
L'électrode négative est un barreau de zincamalgamé
et l'électrode positive est un conteneur en acier rempli d'oxyde
de cuivre.
Cette pile est d'un fonctionnement remarquable, mais la force électromotrice
d'un élément n'est pas très élevée
et ne dépasse pas 0,9 V.
En France, cette pile a été produite et commercialisée
à partir des années 1885 par différentes entreprises
et en particulier par la Société DE BRANVILLE et Co à
Paris qui fournissait l'Administration des Postes et Télégraphes.
Elle a été produite en grande série, à la
même époque, par Edison aux Etats-Unis
1887 la pile sèche « bâton »
YAI Sakizo est sans doute assez méconnu en France, il est
en effet rare de trouver son nom sur les sites français dédiés
aux piles électriques. On en parle un peu sur les pages en anglais
et bien sûr en japonais. Même sur Wikipédia, il n’existe
manifestement qu’une page en japonais qui lui soit consacrée…
A ses débuts, YAI Sakizo n’était pas spécialement
intéressé par les piles. Il était plus séduit
par l’horlogerie, il est d’ailleurs l’inventeur d’une
« montre continue électrique » en 1885.


Or la pile qu’il utilise pour son invention est une « pile
Leclanché », du français Georges Leclanché,
avec laquelle il éprouve quelques difficultés en raison
de la solution qu’utilise cette pile. C’est là qu’il
décide de se pencher sur ce problème de pile et qu’il
met au point un tout nouveau produit en 1887. S’en suivra une bataille
Yai-skizo-Leclanché juridique qui s’achèvera finalement
sur la reconnaissance de YAI: sa pile a été brevetée
en 1892. Sa présentation au monde (à Chicago) en 1893
suscitera enfin l’intérêt d’une très grand
nombre de personnes. Son succès sera confirmé par une
grande utilisation durant la guerre sino-japonaise de 1894-1895.
Ce n’est qu’en 1910, à la toute fin de l’ère
Meiji, que naîtra la société « les piles sèches
YAI » dont les formes seront celles que l’on connaît
toujours aujourd’hui.
Yai-skizo s’éteindra en 1927 et sa société
disparaitra en 1950. Sans doute en raison d’une trop grande concurrence
de tous les géants que l’on connait aujourd’hui dans
le domaine de l’électricité et électro-ménager
comme Panasonic, Toshiba et autres.
Il n’en reste pas moins que c’est bien lui qui a mis au point
ces piles que nous utilisons toujours énormément à
travers le monde
La pile Daniell
Inventée en 1836 par John Frederic Daniell, elle est constituée
par une lame de cuivre et une lame de zinc, chacune plongeant dans une
solution de l'un de ses sels. Par suite de l'existence de la différence
de potentiel métal/solution, lorsque les deux compartiments communiquent
par une jonction électrique, il s'établit une tension
entre les deux conducteurs métalliques. Quand la pile fonctionne,
le courant va du pôle + au pôle -, ce qui correspond à
une circulation d'électrons en sens inverse. Au total, il y a
dépôt de cuivre et dissolution du zinc, selon la réaction
globale : Cu2+ + Zn ? Zn2+ + Cu. C'est la réaction qui se produit
spontanément si on trempe une lame de zinc dans une solution
d'ions cuivriques. Mais l'intérêt du montage précédent
est de permettre la récupération de l'énergie de
cette réaction sous forme d'électricité. (? électrochimie.)

Lorsque M. Daniell fit les premiers essais de cette nouvelle disposition
de la pile, il remarqua, en enlevant un fragment de cuivre qui s’était
déposé sur le cylindre de cuivre C, que les éraillures
de ce conducteur de cuivre se trouvaient fidèlement reproduites
sur le cuivre précipité, provenant de la décomposition
du sulfate de cuivre. Cette observation aurait pu conduire à
la découverte de la galvanoplastie ; mais, comme M. Daniell portait
alors toute son attention sur la marche et la construction de son instrument,
il ne poussa pas plus loin l’examen de ce fait.
1899 la pile Waldemar Jungner, Suède I Jungner invente la pile au nickel-cadmium.
1901 Thomas Edison, conçoit des modèles
de batteries alcalines au nickel-fer.
Pendant de nombreuses années, la batterie plomb-plomb
moderne, ainsi présentée avec tant de fanfare, connut
des difficultés.
Edison, même en tant que complément utile à son
système d'éclairage, fut toujours sceptique, et il fit
remarquer avec mépris que la meilleure batterie de stockage qu'il
connaissait était une tonne de charbon. Les fortunes financières
de la batterie, des deux côtés de l'Atlantique, furent
aussi diverses et désastreuses que son succès industriel
; mais elle finit par émerger et « s'imposer ».
 Voiture fabriquée
par Edison
Voiture fabriquée
par Edison
Edison travaille en 1902 avec son collègue Waldemar Jungner autour
d’une batterie pour automobile avec le couple Nickel-Fer, les deux
métaux étant immergés dans une solution alcaline.
Cette batterie résiste bien au temps et aux décharges
; malheureusement, elle peine à dégager une forte énergie
en peu de temps. Un avantage néanmoins sur les batteries plomb-acide,
courantes à cette époque : elle est moins coûteuse.
Edison, en fervent promoteur des voitures électriques, décide
de prouver l’autonomie de sa batterie : en 1910, il participe à
une course automobile d’endurance, d’une longueur de 1000
miles, avec la Bailey Electric Phaeton. Cependant, la Bailey ne parvient
pas à suivre le rythme des automobiles à essence. En 1915,
le constructeur Bailey abandonne la voiture électrique, tandis
qu’Edison se détourne également du projet.
L'inventeur américain a affirmé que la batterie au nickel-fer
était incroyablement solide et pouvait se recharger deux fois
plus vite que les batteries au plomb-acide. Il a même passé
un accord avec le constructeur automobile Ford Motors pour produire
ce véhicule électrique censé être plus efficace.
Mais la batterie nickel-fer avait quelques problèmes. Elle était
plus grosse que les batteries au plomb-acide utilisées et elle
était également plus chère.
De plus, lorsqu'elle est chargée, elle libère de l'hydrogène,
ce qui à l'époque était considéré
comme préoccupant et pouvait être dangereux.
Malheureusement, au moment où Edison a réussi à
construire un prototype plus raffiné, les véhicules électriques
disparaissaient et les voitures alimentées par des combustibles
fossiles gagnaient du terrain car elles pouvaient parcourir de plus
longues distances au lieu de devoir s'arrêter pour se recharger.
L'accord d'Edison avec Ford Motors est resté inachevé,
bien que sa batterie ait continué à être utilisée
dans certains créneaux tels que la signalisation ferroviaire,
où sa taille encombrante n'était pas un obstacle.
La batterie de stockage est aujourd'hui considérée
comme un complément important et indispensable à presque
tous les systèmes modernes d'éclairage et de chemin de
fer électriques, quelle que soit leur ampleur. et en 1909, malgré
son poids, il avait été adopté dans plus de dix
mille automobiles de types camions, fourgons de livraison, voitures
de plaisance et runabouts en Amérique.
Edison suivit attentivement ces premiers développements
pendant une quinzaine d'années, sans jamais changer d'avis sur
ce qu'il considérait comme les défauts incurables du type
plomb-plomb, mais en vint progressivement à la conclusion que
si une batterie d'accumulateurs d'un autre type, plus performante, pouvait
être mise au point, elle comblerait tous les espoirs initiaux,
aussi extravagants soient-ils, d'hommes comme Kelvin (Sir William Thomson),
et deviendrait aussi nécessaire et universelle que la lampe à
incandescence ou le moteur électrique. Le début du siècle
présent le trouva à un nouveau départ. D'une manière
générale, les personnes non techniques et non initiées
ont tendance à considérer une invention comme le résultat
ultime d'une heureuse inspiration. Et, en effet, il ne fait aucun doute
que tel peut être le cas dans certains cas ; mais, dans la plupart
des cas, l'inventeur a délibérément cherché
à atteindre un résultat précis et souhaité,
principalement en appliquant les lois connues de l'art dans lequel il
travaille. Il est cependant rare qu'un homme se lance délibérément,
comme Edison, dans le développement d'un type radicalement nouveau
d'un dispositif aussi complexe que la batterie d'accumulateurs, avec
seulement un fil conducteur et un point de départ vague.
Compte tenu du succès du problème qu'il entreprit de résoudre
en 1900, il sera intéressant de revenir sur son état d'esprit
à cette époque. lors de la fermeture de l'usine de concentration
de minerai de fer magnétique d'Edison, dans le New Jersey, il
décida de travailler sur un nouveau type de batterie de stockage.
C'est à cette époque que, lors d'une conversation avec
M. R.H. Beach, alors employé du département tramway de
la General Electric Company, il déclara : « Beach, je ne
pense pas que la nature serait assez cruelle pour nous cacher le secret
d'une BONNE batterie de stockage si on la recherche sérieusement.
Je vais la chercher. »
On a souvent demandé à Edison quel était, selon
lui, le secret de la réussite. Il a invariablement répondu
: « Un travail acharné, basé sur une réflexion
approfondie. » Les archives de laboratoire témoignent
pleinement qu'il a systématiquement suivi cette prescription
à la lettre. La perfection de toutes ses grandes inventions a
été marquée par un effort patient, persistant et
incessant qui, ne reconnaissant rien de moins que le succès,
a conduit à l'accomplissement ultime de ses idées. Optimiste
et plein d'espoir, Edison a l'heureuse faculté de commencer la
journée avec l'esprit ouvert d'un enfant, les déceptions
et les échecs d'hier étant écartés et ignorés
par les possibilités séduisantes de demain.
De toutes ses inventions, il est douteux qu'une seule ait suscité
plus de réflexion originale, de travail, de persévérance,
d'ingéniosité et de patience monumentale que celle dont
nous parlons aujourd'hui. L'un de ses associés, qui a vécu
avec lui pendant de nombreuses années le travail fastidieux sur
les batteries de stockage, a déclaré : « Si les
expériences, les recherches et les travaux d'Edison sur cette
batterie étaient tout ce qu'il avait jamais fait, je dirais qu'il
était non seulement un inventeur remarquable, mais aussi un grand
homme. Il est presque impossible d'apprécier les énormes
difficultés qu'il a surmontées. » Après des
débuts pratiquement obscurs, il fallut attendre plus de dix mille
expériences pour obtenir des résultats préliminaires
positifs. Malgré toutes ces recherches, aucun signe de l'action
électrique recherchée n'avait été observé.
Ces expériences s'étaient étalées sur plusieurs
mois de travail incessant, jour et nuit, sans que la foi d'Edison en
son succès final ne s'en trouve ébranlée, ni ses
espoirs optimistes et confiants. L'échec d'une expérience
signifiait simplement pour lui qu'il avait trouvé autre chose
qui ne fonctionnerait pas, rapprochant ainsi un peu plus son objectif
potentiel par un processus d'élimination minutieux.
Cependant, après ces nombreux mois de travail acharné, au cours desquels il avait examiné et testé pratiquement tous les éléments connus dans de nombreuses combinaisons chimiques, l'action électrique qu'il recherchait était obtenue, lui offrant ainsi les premiers aperçus du secret qu'il avait ardemment tenté d'arracher à la Nature. Il faut garder à l'esprit que, dès le départ, Edison avait dédaigné toute intention de suivre les seules pistes alors connues, en utilisant le plomb et l'acide sulfurique comme composants d'une batterie de stockage performante. Impressionné par ce qu'il considérait comme les graves défauts inhérents aux batteries fabriquées avec ces matériaux, et par la complexité extrême des réactions chimiques se produisant dans tous les types de piles, il décida hardiment, dès le départ, de concevoir une batterie sans plomb, intégrant une solution alcaline – une forme qui, il en était fermement convaincu, serait intrinsèquement moins sujette à la dégradation et à la dissolution que le type standard, qui, après de nombreux échecs, avait finalement permis une production annuelle de plusieurs milliers de piles, valant des millions de dollars.
Deux ou trois mille des premières expériences suivirent la ligne de sa célèbre pile primaire dans la tentative d'emploi de l'oxyde de cuivre comme élément dans un nouveau type de cellule de stockage ; mais son utilisation n'offrait aucun avantage, et la chasse se poursuivit dans d'autres directions et se poursuivit jusqu'à ce qu'Edison se soit assuré par un grand nombre d'expériences que le nickel et le fer possédaient les qualifications souhaitables qu'il recherchait. Cette immense enquête, qui avait mobilisé tant de mois de travail et qui avait abouti à la découverte d'une série de réactions prometteuses entre le nickel et le fer, ouvrit à Edison les portes d'un territoire étrange et jusqu'alors inexploré. Lentement mais sûrement, les résultats de ses derniers milliers d'expériences préliminaires lui avaient inévitablement révélé une région nouvelle et fertile. Il avait découvert le passage secret et détenait la clé qu'il avait tant cherchée. Et maintenant, ayant tracé une voie précise, Edison était tout déterminé à poursuivre son chemin avec vigueur afin de pouvoir pénétrer dans ce territoire et en prendre possession.
C'est un dicton banal que « l'histoire se répète », et aucun axiome n'est plus vrai que celui-ci lorsqu'il s'applique à l'histoire de chacune des inventions importantes d'Edison. Le développement de la batterie de stockage n'a pas fait exception ; loin de là, car au cours des dix années qui se sont écoulées depuis qu'il s'est mis à travailler, avec ses mécaniciens, chimistes, machinistes et expérimentateurs, à la mise au point d'une pile commerciale pratique, la vieille histoire des efforts incessants et persistants, si manifestes dans la mise au point d'autres inventions, s'est pleinement répétée.
Peu de temps après avoir décidé d'utiliser le nickel et le fer comme métaux élémentaires pour sa batterie, Edison établit une usine chimique à Silver Lake, dans le New Jersey, à quelques kilomètres du laboratoire d'Orange, sur un terrain acheté quelque temps auparavant. Ce lieu fut le théâtre d'expériences ultérieures visant à développer les différentes formes chimiques du nickel et du fer, et à déterminer par des tests celles qui seraient les mieux adaptées à une utilisation dans des cellules fabriquées à l'échelle commerciale. Entouré d'une poignée d'expérimentateurs triés sur le volet, Edison se lança dans l'une de ses luttes caractéristiques pour la suprématie. C'était, dans une certaine mesure, un retour aux anciennes journées (ou plutôt aux nuits) de Menlo Park. Certains de ceux qui avaient travaillé sur les expériences préliminaires, ainsi que quelques nouveaux venus, travaillèrent ensemble malgré le temps qui passait et souvent dans des conditions très décourageantes, mais avec ce remarquable esprit de corps qui a toujours marqué les relations d'Edison avec ses collègues et qui a si largement contribué à la réussite de ses idées.
Le groupe qui a pris part à ces premières
années de travail ardu d'Edison comprenait son ancien assistant,
Fred Ott, ainsi que son chimiste, JW Aylsworth, ainsi que EJ Ross, Jr.,
WE Holland et Ralph Arbogast, et un peu plus tard WG Bee, qui ont tous
grandi avec la batterie et consacrent toujours leur énergie à
son développement commercial. L'un de ces ouvriers, relatant
les expériences pénibles de ces quelques années,
raconte : « C'était un travail pénible et de longues
heures, mais il y avait quand même quelques choses qui rendaient
la vie agréable. L'une d'elles était l'heure du dîner
dont nous appréciions le plus lorsque nous travaillions le soir.
M. Edison faisait livrer le dîner vers minuit, et nous nous asseyions
tous ensemble, lui y compris. On oubliait le travail pour l'instant,
et tout le monde était prêt à s'amuser. J'ai de
très bons souvenirs de M. Edison à ces moments-là.
Il se détendait toujours et contribuait à rendre le moment
agréable, et je l'ai parfois vu déborder d'énergie,
comme un garçon qui sort de l'école. Mais après
le dîner, il redevenait l'inventeur sérieux et énergique,
profondément absorbé par son travail. »
Il aimait beaucoup raconter et écouter des histoires, et appréciait
toujours une blague. Je me souviens d'une qu'il aimait bien nous raconter
de temps en temps. Notre système d'éclairage était
en double, et vers 12 h 30 ou 1 h du matin, à la fin du dîner,
on changeait d'éclairage : l'éclairage électrique
s'éteignait progressivement et revenait lentement à la
puissance des bougies, le tout prenant probablement une trentaine de
secondes. Parfois, pendant ce temps, Edison croisait les mains, se calmait
comme s'il dormait profondément, et lorsque les lumières
étaient à nouveau allumées, il semblait se réveiller
en disant : « Eh bien, les gars, on s'est bien reposés
; maintenant, remettons-nous au travail. »
Un autre souvenir intéressant et amusant de cette période d'activité a été recueilli auprès d'un autre membre de la famille d'expérimentateurs : « Parfois, après de longues heures de travail, M. Edison avait envie d'une petite sieste. C'était l'une des choses les plus drôles que j'aie jamais vues : le voir se glisser dans un simple bureau à cylindre, se recroqueviller et faire une sieste. Plus drôle encore, le voir se retourner sur le côté, tout en restant assis à son bureau. Il utilisait plusieurs volumes du Dictionnaire de chimie de Watts comme oreiller, et nous, les gars, disions qu'il en absorbait le contenu pendant son sommeil, à en juger par le flot d'idées nouvelles qu'il avait au réveil. »
De tels incidents ne servent qu'à illustrer les moments plus légers qui se détachent du contexte plus sombre de ces années difficiles. Car, de toutes les périodes intenses et absorbantes de la vie inventive d'Edison, les cinq premières années de l'ère des accumulateurs furent parmi les plus intenses. Non pas qu'il restait un principe fondamental à découvrir ou à simplifier, car cela avait déjà été fait ; mais c'est dans la mise en pratique de ces principes que surgirent de nombreuses difficultés, parfois insurmontables. Mais, selon un autre collègue, « Edison semblait heureux lorsqu'il se heurtait à une difficulté majeure. Cela semblait lui redonner courage et le rendre plus prolifique en idées nouvelles. Pendant un temps, j'ai pensé qu'il était stupide d'imaginer une telle chose, mais je n'ai jamais pu me défaire de l'impression qu'il paraissait réellement heureux lorsqu'il se heurtait à un obstacle majeur. C'était dans ma jeunesse, et j'ai vite appris que l'échec d'une expérience ne le décourage jamais, sauf s'il est dû à la négligence de son auteur. Edison se sent alors dégoûté. Si l'expérience échoue sur le fond, il ne s'en inquiète pas, mais, au contraire, la considère comme un apprentissage utile ; il reste optimiste et tente autre chose. Je l'ai vu revenir sur une expérience infructueuse et s'en sortir sans problème. »
Suivre en détail les traces d'Edison à travers les innombrables péripéties de ses expérimentations et recherches sur la batterie de stockage, au cours des dix dernières années, ne cadrerait pas avec le propos de ce récit et ne servirait à rien. De plus, de tels détails occuperaient un volume considérable. Le récit, cependant, ne serait pas complet sans une brève description des grandes lignes de son travail, et nous pouvons en citer brièvement quelques-uns des points principaux. Et pour que le lecteur ne pense pas que le mot « innombrables » ait été employé à la légère ou à la hâte, nous citerons la réponse d'un assistant de laboratoire lorsqu'on lui a demandé combien d'expériences avaient été réalisées sur la pile d'accumulateurs Edison depuis 1900 : « Dieu seul le sait ! Nous numérotions nos expériences de 1 à 10 000, et lorsque nous arrivions à 10 000, nous revenions à 1, puis à 10 000, et ainsi de suite. Nous avons parcouru plusieurs séries – je ne sais pas combien, et j'en ai perdu la trace maintenant, mais il y en avait près de cinquante mille. »
Dès le départ, l'idée générale
d'Edison pour sa batterie de stockage consistait à fabriquer
des conteneurs métalliques perforés contenant les matériaux
actifs : de l'hydrate de nickel pour la plaque positive et de l'oxyde
de fer pour la plaque négative. Ce plan a été respecté
jusqu'à la fin et a trouvé son aboutissement dans la forme
actuelle de la pile commerciale achevée. Cependant, entre les
débuts rudimentaires et le modèle perfectionné
d'aujourd'hui, se trouve un monde de réflexion originale, de
travail patient et de réussite.
La première nécessité était naturellement
d'obtenir les composés les plus purs et les plus performants
pour les matières actives. Edison constata que les chimistes
industriels connaissaient relativement peu de choses sur les oxydes
de nickel et de fer de la haute qualité et de la pureté
qu'il recherchait. Il lui fallut donc créer sa propre usine chimique
et la confier à des hommes spécialement formés
par lui-même, avec qui il travailla. Il s'agissait de l'usine
de Silver Lake, mentionnée plus haut. Pendant plusieurs années,
la préparation de ces composés chimiques, par tous les
procédés imaginables et les tests ultérieurs, y
connut une activité incessante. Le chimiste en chef d'Edison
explique : « Nous avons tout mis en œuvre pour trouver un
moyen de fabriquer ces produits chimiques afin qu'ils donnent les meilleurs
résultats. Nous avons mené les expériences avec
les deux produits ensemble. Parfois, le nickel était en tête
des tests, puis il était en retard. Pour nous encourager à
progresser davantage, Edison a accroché une carte indiquant les
résultats des tests en milliampères-heures obtenus par
les éléments expérimentaux, tandis que nous les
testions avec les différentes qualités de nickel et de
fer que nous avions fabriquées. Cela a suscité une grande
ambition chez les garçons, qui souhaitaient augmenter les valeurs.
Certains de nos premiers tests ont montré environ 300, mais à
mesure que nous améliorions le matériau, elles ont progressivement
dépassé 500. À cette époque, Edison a fait
un voyage au Canada et, à son retour, nous avions tellement progressé
que les valeurs avaient grimpé jusqu'à environ 1 000.
Je me souviens très bien de sa grande satisfaction. »
À propos du développement de l'élément négatif de la pile, M. Aylsworth déclara : « De la même manière, le fer a dû être développé et amélioré ; et finalement, le fer, qui avait généralement bénéficié d'une capacité supérieure à son homologue, le nickel, a dû subir une formation afin de conserver son plomb, ce qui était impératif pour produire une courbe de tension uniforme et constante. Un jour, discutant avec moi des difficultés auxquelles nous étions confrontés et les comparant à l'expérimentation sur le phonographe, Edison m'a dit : « En phonographie, nous pouvons utiliser nos oreilles et nos yeux, aidés de puissants microscopes ; mais avec la pile, nos difficultés ne peuvent être ni vues ni entendues, mais doivent être observées par l'œil de l'esprit ! » Et grâce à cette vision passée, Edison est maintenant capable de voir clairement à travers la forêt de difficultés après les avoir éliminées une à une. »
La taille et la forme des alvéoles des plaques ou éléments de la batterie, ainsi que leur degré de perforation, ont fait l'objet de nombreuses années d'études et d'expérimentations approfondies. De fait, leur perfectionnement est encore aujourd'hui l'objet d'un travail constant, bien que leur forme générale actuelle ait été définie il y a plusieurs années. La construction mécanique de la batterie, dans son ensemble, dans sa forme actuelle, force l'admiration par sa beauté et sa perfection. M. Edison n'a épargné ni réflexion, ni ingéniosité, ni travail, ni argent pour en faire la cellule de stockage la plus complète et la plus performante possible, et les résultats démontrent que son talent, son jugement et sa clairvoyance n'ont rien perdu de la puissance qui a fondé et bâti d'autres grands arts à chacune des étapes précédentes de sa carrière.
Parmi les nombreux et complexes problèmes qui se posèrent lors de l'évolution de la batterie figurait celui de la conductivité interne de l'unité positive. L'hydrate de nickel était un mauvais conducteur électrique, et même si une poche de nickel métallique en était remplie, l'action électrique souhaitée ne se produirait pas sans un mélange de substance conductrice, incorporée et compactée de manière à assurer un bon contact électrique. Ce problème s'avéra être des plus complexes et complexes, délicat et évasif, laissant toujours entrevoir quelque chose, pour finalement s'évanouir, laissant le travail inachevé. La patience et la persévérance remarquables d'Edison face à ce problème épineux et le résoudre finalement lui valurent une admiration plus que banale de la part de ses collaborateurs. L'un d'eux, évoquant les expériences apparemment interminables menées pour résoudre ce problème, déclara : « Je suppose que cette question de la conductivité de la poche positive lui a donné des cheveux blancs. Je n'aurais jamais imaginé qu'un homme puisse faire preuve d'une telle patience et d'une telle persévérance. N'importe quel autre homme qu'Edison aurait abandonné mille fois, mais pas lui ! La situation paraissait souvent sombre à nos yeux, mais il était toujours optimiste. Je me souviens d'une fois où la situation me paraissait si sombre que j'étais sur le point de quitter mon emploi, mais un heureux hasard est arrivé et je n'ai pas hésité. Aujourd'hui, je suis heureux d'avoir persévéré, car nous avons un bel avenir devant nous. »
La difficulté d'obtenir un bon contact électrique dans l'élément positif fut en effet le principal problème d'Edison pendant de nombreuses années. Après de nombreux travaux et expérimentations, il opta pour une forme de graphite qui semblait convenir à cet usage, puis lança la fabrication commerciale de la pile dans une usine spécialement installée à Glen Ridge, dans le New Jersey. Les acheteurs ne manquaient pas, mais l'usine était incapable de produire suffisamment de piles. Les journaux avaient déjà publié des articles soulignant la capacité et les performances inhabituelles de la pile, suscitant ainsi un vif intérêt du public.
Malgré l'instauration d'un système régulier de fabrication et de vente, Edison ne cessa d'expérimenter pour améliorer la batterie. Bien que le graphite ait apparemment rempli les fonctions attendues, il n'était pas entièrement satisfait de ses performances et procéda à des essais approfondis avec d'autres substances, mais ne trouva rien de plus satisfaisant à l'époque. Des tests continus des cellules commerciales furent effectués en laboratoire, ainsi que des essais plus pratiques et plus rigoureux sur des automobiles, constamment en circulation dans la campagne environnante, sur toutes sortes de routes. Tous ces tests étaient surveillés de très près par Edison, qui exigeait que les différents essais de la batterie soient menés avec la plus grande rigueur afin d'obtenir les meilleurs résultats et de détecter toute faiblesse éventuelle. Il insistait tellement sur ce point que si une automobile roulait plusieurs jours sans crever un pneu ou casser une pièce, il accusait le chauffeur de choisir des chemins faciles.
Après que ces tests eurent duré un certain temps, et que des milliers de cellules eurent été vendues et donnèrent des résultats satisfaisants aux acheteurs, les feuilles de tests et l'expérience acquise auprès de diverses sources indiquèrent qu'il arrivait qu'une cellule, ici ou là, présente une capacité insuffisante. Les procédés de fabrication étant très précis et soigneusement contrôlés, et chaque cellule étant fabriquée de manière aussi uniforme que le permettaient les compétences et le soin humains, un sérieux problème surgit. Edison concentra ses efforts sur l'étude de ce problème et découvrit que la cause principale résidait dans le graphite. D'autres problèmes mineurs retinrent également son attention. La question importante qui se posait à lui était de savoir quoi faire. Fermer l'usine signifiait de lourdes pertes et une apparente défaillance. Il en était pleinement conscient, mais il savait aussi que poursuivre ne ferait qu'augmenter le nombre de batteries défectueuses en circulation, ce qui entraînerait à terme une fermeture définitive et une véritable défaillance. Il adopta donc la ligne de conduite que l'on pouvait attendre du bon sens et de la franchise d'Edison. Insatisfait du succès total de la batterie, il ferma l'usine et reprit ses expériences.
« Et puis », raconte l'un des laborantins, « nous avons entamé une nouvelle série d'expériences record qui ont duré plus de cinq ans. J'irais presque jusqu'à dire déchirantes, car de toutes les choses insaisissables et décevantes que l'on ait jamais recherchées, c'était la pire. Mais les secrets doivent être longs et bien cachés pour échapper au « Vieux » qui les traque. Il ne s'énerve pas s'il les rate, il continue de sourire et de tirer, et les ramène généralement au camp. C'est ce qu'il a fait avec la batterie : après un travail acharné, il a perfectionné l'idée et le procédé des paillettes de nickel, et a apporté une grande amélioration : l'utilisation de tubes au lieu de poches plates pour le positif. Il a également apporté une petite amélioration ici et là, et nous avons maintenant une batterie plus performante que nous ne l'aurions jamais imaginé. »
Entre-temps, alors que les expérimentations de
ces cinq dernières années se poursuivaient, de nombreux
clients ayant acheté des batteries du modèle original
frappèrent à la porte, commandant des équipements
supplémentaires pour équiper davantage de wagons et de
camions. Edison exprima ses regrets, mais déclara ne pas être
satisfait des anciennes cellules et s'employait à les améliorer.
Les clients répondirent alors qu'ils étaient entièrement
satisfaits et prêts à payer pour d'autres batteries du
même type ; mais Edison ne put se laisser influencer par sa détermination,
malgré des pressions parfois considérables.
L'expérimentation s'est poursuivie au-delà du possible
et, après la construction de nouvelles machines, la fabrication
du nouveau type de cellule a débuté au début de
l'été 1909. À l'heure actuelle, elle progresse
aussi vite que les machines supplémentaires nécessaires
peuvent être fabriquées. Le produit est expédié
dès son achèvement.
La lamelle de nickel, solution ingénieuse d'Edison au
problème de la conductivité, est en soi un produit des
plus intéressants, d'une application extrêmement pratique
et d'une fabrication fascinante. Elle est obtenue par galvanoplastie
sur un cylindre métallique de couches alternées de cuivre
et de nickel, cent de chaque, après quoi la feuille combinée
est retirée du cylindre. Les couches sont si fines que cette
feuille n'a qu'environ l'épaisseur d'une carte de visite, et
pourtant elle est composée de deux cents couches de métal.
La feuille est découpée en minuscules carrés d'environ
un seizième de pouce chacun, puis placée dans un bain
où le cuivre est dissous. Cela libère les couches de nickel,
de sorte que chacun de ces petits carrés devient une centaine
de minuscules feuilles, ou lamelles, de nickel métallique pur,
si fines qu'une fois sèches, elles flottent dans l'air, comme
du duvet de chardon. Pour la fabrication de piles, les paillettes sont
utilisées grâce à une machine spéciale, conçue
de telle sorte que de petites charges d'hydrate de nickel et de paillettes
de nickel sont introduites alternativement dans les alvéoles
destinées aux positifs, puis compactées avec une pression
d'environ quatre tonnes par pouce carré. Ceci assure un contact
parfait et, par conséquent, une conductivité électrique
dans toute l'unité.
Le développement de la lamelle de nickel est un récit de patientes recherches, de travail et de réussites, mais nous n'avons pas la place de le consacrer, ni de retracer l'immense travail accompli pour développer et perfectionner les nombreux autres composants et accessoires de cette remarquable pile. Il suffit de dire que lorsqu'Edison s'est lancé avec audace dans de nouveaux territoires, à la recherche d'un objet totalement inconnu, il était prêt à travailler dur et à explorer. Il a exploré ces deux domaines sans compter, mais a persévéré jusqu'à ce qu'après un long voyage, il ait trouvé tout ce qu'il attendait et accompli quelque chose de plus. La nature a répondu à son appel enthousiaste et, à la fin de la quête, a révélé une pile de stockage performante d'un type entièrement nouveau. Edison a non seulement reconnu et exploité les principes qu'il avait découverts, mais en les adaptant à un usage commercial, il a développé des procédés et des dispositifs mécaniques des plus ingénieux pour mettre ses découvertes en pratique. En effet, on peut dire que l’invention d’une énorme variété de nouvelles machines et d’appareils mécaniques rendus nécessaires par chaque changement au cours des différentes étapes de développement de la batterie, de la première à la dernière, constitue un hommage durable à l’étendue et à la polyvalence de ses pouvoirs.
Il n'entre pas dans le cadre de ce récit de décrire
les mérites relatifs de la batterie d'accumulateurs Edison, cette
tâche étant du ressort d'un catalogue commercial. Il semble
toutefois tout à fait légitime de souligner que, si, à
l'heure actuelle, les tests effectués ne s'étendent que
sur quelques années, leurs résultats et la valeur intrinsèque
de cette invention caractéristique d'Edison sont d'une telle
ampleur qu'ils laissent présager la croissance inévitable
d'une autre grande industrie issue de sa fabrication, et de son application
généralisée à de nombreux usages.
L'usage principal envisagé par Edison pour sa batterie est le
transport de marchandises et de passagers par camion, automobile et
tramway. La capacité considérablement accrue par rapport
à son poids la rend particulièrement adaptée à
ce type d'utilisation, grâce à son rayon de déplacement
bien plus grand. Ce dernier avantage est celui qui séduit le
plus l'automobiliste, puisqu'il peut ainsi parcourir, affirme-t-on,
plus de trois fois plus de distance qu'auparavant avec une seule charge
de batterie.
Edison estime que l'utilisation de sa batterie de stockage pour la propulsion
des tramways présente d'importants avantages.
Dans le système d'exploitation actuel, une installation fournissant
l'énergie électrique aux tramways doit être suffisamment
grande pour fournir le courant nécessaire à la charge
maximale aux heures de pointe, même si une grande partie des machines
peut rester inutilisée et improductive aux heures de charge minimale.
Grâce à l'utilisation de wagons à batterie de stockage,
cet investissement maximal, immense et peu rentable, peut être
ramené à des proportions véritablement économiques,
car la charge des batteries peut être assurée à
un rythme uniforme avec un investissement raisonnable pour la production
d'énergie. De plus, chaque wagon devient une unité mobile
indépendante, non sujette aux retards dus à une panne
générale de la centrale ou de la ligne. Outre ces avantages,
les rues seraient libérées du poids des câbles et
des canalisations de tramway. Pour mettre ses idées en pratique,
Edison construisit une courte ligne de chemin de fer à l'usine
d'Orange durant l'hiver 1909-1910 et, en collaboration avec M. R.H.
Beach, construisit un type spécial de tramway, qu'il équipa
d'un moteur, d'une batterie de stockage et des autres dispositifs de
fonctionnement nécessaires. Ce tramway fut ensuite installé
sur les lignes de tramway de New York et démontra son efficacité
à tel point qu'il fut racheté par l'une des compagnies
de tramway, qui en commanda depuis des wagons supplémentaires
pour ses lignes. La démonstration de ce premier tramway a été
suivie avec intérêt par de nombreux responsables ferroviaires,
et ses performances furent si fructueuses qu'à l'heure où
nous écrivons (été 1910), il a fallu organiser
et équiper une usine préliminaire pour la construction
de nombreux autres tramways de type similaire, commandés par
d'autres compagnies de tramway. Cette entreprise sera menée par
une société spécialement créée à
cet effet. Ainsi a été initié le développement
d'une nouvelle et importante industrie dont les dimensions finales dépassent
les prévisions actuelles. Aussi vaste que puisse devenir cette
industrie, Edison est fermement convaincu que le plus grand domaine
d'application de sa batterie de stockage réside dans son adaptation
au transport routier et commercial, ainsi qu'aux véhicules de
plaisance, en comparaison desquels le secteur des tramways, même
avec ses grandes possibilités, ne représentera pas plus
de 1 %.
1910 Edison a résumé succinctement son travail et ses idées dans un article sur « Les lendemains de l'électricité et de l'invention » paru dans Popular Electricity de juin 1910. Il y écrit : « Depuis des années, j'essaie de perfectionner une batterie de stockage et je l'ai maintenant rendue parfaitement adaptée à l'automobile et à d'autres travaux. Il n'y a absolument aucune raison d'autoriser les chevaux en ville ; car entre l'essence et la voiture électrique, il n'y a plus de place pour eux. Ils ne sont plus nécessaires. La vache et le cochon ont disparu, et le cheval est encore plus indésirable. Un idéal public plus élevé de santé et de propreté œuvre très rapidement vers un tel bannissement ; et alors, nous aurons des rues décentes, au lieu d'écuries faites de bandes de pavés bordées de trottoirs. Le pire usage de l'argent est de construire une belle artère, puis de la confier aux chevaux. De plus, ce changement entraînera la faillite des sociétés protectrices des animaux. Nombreux sont ceux qui rechargent aujourd'hui leurs batteries eux-mêmes, faute d'installations ; mais je crois que les centrales électriques trouveront dans ce travail de grands avantages. » Bientôt la plus grande partie de leur charge. La New York Edison Company, ou la Chicago Edison Company, devrait avoir autant de courant pour les batteries de stockage que pour les moteurs électriques ; et ce sera bientôt le cas.
La Pile GUIRAUD

C'est une pile à deux électrolytes : eau salée
et bichromate de potassium. La force électromotrice de cet élément
est de 2V.
Cette pile comporte un vase poreux de diamètre relativement grand
qui sépare les deux électrolytes. Le dépolarisant
est à base de bichromate et est mis à l'intérieur
du vase poreux. Une électrode en charbon composé d'un
faisceau de lames réunies par une pièce spéciale
en laiton plonge dans ce liquide. Le zinc circulaire, non amalgamé,
plonge dans une solution de chlorure de sodium (sel marin) à
raison de 325 g /l. Il est suspendu par des crochets.
C'était une pile "sans mercure" et déjà
écologique pour l'époque ... bien que le bichromate ne
soit pas un produit facile à manipuler.
Cette pile était vendue pour ses bonnes caractéristiques
de stabilité dans le temps et le prix de revient du courant produit
était "5 à 6 fois moins élevé que les
autres types de piles" suivant des tests réalisés
à l'époque.
Son inventeur avait reçu une médaille d'or au concours
de Inventions de Marseille de 1909.
1914-18 La Pile FERY
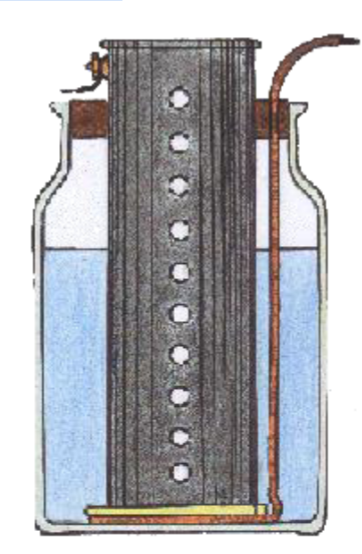

Leur emploi était très répandue dans les années
20 comme en témoigne la publicité d'époque ci-dessus.
Pour une raison historique, la pile FERY mérite d'être
évoquée. Cette pile a été développée
pendant la guerre de 14-18, à la demande du Général
FERRIE, pour satisfaire les besoins de la Télégraphie
Militaire.
A cette époque le bioxyde de manganèse nécessaire
à la fabrication des piles de type Leclanché provenait
de gisements naturels depyrolusite (bioxyde double de manganèse
et de fer) et exigeait un minerai de grande pureté chimique.
Un tel minerai, rare en France, était importé d'Allemagne
et était devenue, du fait de la guerre, une matière première
sensible.
Compte tenu de ces restrictions d'approvisionnement, Charles FERY examine
s'il ne serait pas possible de remplacer ce bioxyde par l'oxygène
de l'air qui est présent partout et qui est, de plus, totalement
gratuit. Il met au point une pile d'un nouveau type "à dépolarisant
par l'air" dont le
fonctionnement s'avère remarquable et le coût de production
et d'entretien tout à fait satisfaisant.

Le pôle + de cette pile est constitué d'un tube de charbon
poreux qui dépasse largement au dessus du vase et dans lesquels
se fait la recombinaison de l'hydrogène (naissant) avec de l'oxygène
présent.
Le zinc est placé au fond du vase et dans ces conditions, il
n'est pas attaqué par l'oxygène de l'air.
L'hydrogène est généré dans la partie basse
du charbon et disparaît en période de repos de la pile
sous l'effet de l'activation d'une "pile interne" qui le recombine
en eau, en partie haute du charbon, près de la surface chargée
en oxygène de l'air.
Les piles FERY sont caractérisées par une très
grande capacité massique. Il était possible d'obtenir
au minimum 90 ampères-heures avec 100 grammes de sel d'ammoniac
pour une pile dont le poids ne dépassait pas 2,1 Kg.
En 1947, Neumann réussit à étanchéifier
complètement l'accumulateur. Ces progrès conduisirent
à la batterie moderne étanche au nickel-cadmium.
Plus d'un siècle plus tard, les ingénieurs
ont redécouvert la batterie nickel-fer comme une sorte de diamant
brut.
Elle est actuellement étudiée comme une réponse
au défi permanent de la production d'énergie renouvelable
et de la complémentarité des sources d'énergie
propres telles que le vent et le solaire.
Et l'hydrogène, autrefois considéré comme dangereux,
pourrait devenir l'un des éléments les plus utiles de
ces batteries.
Au milieu des années 2010, une équipe de recherche de
l'Université de technologie de Delft aux Pays-Bas a découvert
comment utiliser la batterie nickel-fer à base d'hydrogène.
Lorsque l'électricité traverse la batterie lors de sa
recharge, elle subit une réaction chimique qui libère
de l'hydrogène et de l'oxygène.
L'équipe a reconnu que la réaction ressemble à
celle utilisée pour libérer de l'hydrogène de l'eau,
connue sous le nom d'électrolyse.
"Il m'a semblé que la chimie était la même",
explique Fokko Mulder, chef de l'équipe de recherche à
l'Université de Delft.
Cette réaction de division de l'eau est un moyen par lequel l'hydrogène
est produit pour être utilisé comme carburant et complètement
propre, à condition que l'énergie utilisée pour
conduire la réaction provienne d'une source renouvelable.
Alors que Mulder et son équipe savaient que les électrodes
de batterie nickel-fer étaient capables de diviser l'eau, ils
ont été surpris de voir que les électrodes ont
commencé à avoir un stockage d'énergie plus important
qu'avant la production d'hydrogène.
En d'autres termes, elle est devenue une meilleure batterie lorsqu'elle
a également été utilisée comme électrolyseur.
Ils ont également été étonnés de
voir à quel point les électrodes résistaient à
l'électrolyse, qui peut dégrader excessivement des batteries
plus traditionnelles.
"Et bien sûr, nous étions heureux que l'efficacité
énergétique semble être bonne dans tout cela",
dit Mulder, atteignant des niveaux de 80 % à 90 %.
Mulder a nommé sa création le "battolyser" et
espère que la découverte pourra aider à résoudre
deux défis majeurs pour les énergies renouvelables : stocker
l'énergie et, lorsque les batteries sont pleines, produire du
carburant propre.
"Vous entendrez des arguments sur les batteries d'une part et l'hydrogène
d'autre part", dit Mulder. "Il y a eu toujours une sorte de
compétition entre les deux, mais en gros il faut les deux",
ajoute-t-il.
Les piles thermo-électriques sont des appareils qui transforment directement la chaleur en électricité.
La première de ces piles fut construite en 1821,
par Thomas Seebeck, professeur de physique à Berlin. Elle
se composait d’une barre de bismuth, sur laquelle étaient
soudées les extrémités d’une lame de cuivre,
recourbée de manière à laisser un espace vide entre
les deux métaux. En chauffant l’une des soudures de ce système,
Seebeck reconnut qu’il se produisait un courant électrique
se dirigeant de la soudure chaude à travers le barreau de bismuth.
Les lois des phénomènes que présentent les générateurs
thermo-électriques furent établies en 1823, par A. C.
Becquerel. L’illustre physicien observa : qu’entre les mêmes
limites de températures, on obtient, suivant les métaux
employés, des courants d’intensité variable, qui
correspondent à des pouvoirs thermo-électriques différents
; — qu’il existe, à des températures différentes,
des courants thermo-électriques entre deux portions d’un
même métal homogène ; — qu’enfin, les
mêmes phénomènes se reproduisent encore au contact
des liquides et des solides, et des liquides entre eux.
Œrsted et Fourier, sur les indications de Seebeck, construisirent
une pile thermo-électrique, composée de barreaux de bismuth,
qui se terminaient par une partie soudée, qu’on refroidissait
avec de la glace, tandis que les autres soudures étaient chauffées
à l’aide de petites lampes à alcool.
Pouillet construisit, pour ses recherches sur les lois des courants,
une pile thermo-électrique formée de lames de cuivre et
de cylindres de bismuth soudés alternativement les uns aux autres.
Il suffit, pour mettre cette pile en fonction, de plonger dans de l’eau
chaude toutes les soudures impaires, et de placer toutes les soudures
paires dans de la glace.
La Pile thermo-électrique de Nobili.

Dans la pile de Nobili, qui est composée de bismuth
et d’antimoine, toutes les soudures paires sont d’un côté
et les soudures impaires de l’autre. Généralement,
cette pile consiste en un premier couple sur lequel on place une feuille
de papier verni, puis un second couple semblable au précédent
et relié avec lui. On continue à superposer et à
isoler de la même manière un certain nombre de ces couples
jusqu’à ce que la pile forme un parallélépipède,
que l’on mastique dans une pièce rectangulaire de cuivre,
de façon que les soudures soient découvertes et présentent
deux faces que l’on enduit de noir de fumée pour les rendre
plus sensibles à l’action de la chaleur. De chaque côté
de la monture de la pile sont fixées deux bornes correspondant
: l’une avec le premier bismuth et l’autre avec le dernier
antimoine. L’appareil est supporté par un poids à
charnière qui permet de lui donner toutes les positions voulues.
Enfin, et pour que la chaleur environnante n’influe pas sur la
pile, celle-ci est renfermée dans un étui rectangulaire
dont les extrémités sont munies d’écrans au
moyen desquels on peut ne laisser arriver la chaleur que sur l’une
de ses faces.
Cette pile est une simplification et un perfectionnement de celle d’Œrsted
et Fourier ; elle mesure environ deux centimètres cubes de côté,
et renferme cinquante couples. Melloni l’a appliquée à
l’étude du rayonnement de la chaleur.
Dans l’industrie on a utilisé plusieurs
alliages à la formation des piles thermo-électriques,
dans le but d’obtenir un courant plus intense.
C’est ainsi que MM. Mathiessen, Marcus, Wheatstone et Ladd
ont employé un alliage de nickel, de cuivre et de zinc, et un
autre formé de bismuth, de zinc et d’antimoine. Ils ont
pu, à l’aide de cette pile, rendre incandescent un fil de
platine et obtenir des étincelles d’une bobine Rhumkorff.
M. Farmer, de Boston, a construit une pile de ce genre, dont
les lames positives étaient formées par un alliage de
cuivre, de zinc et de nickel, et les lames négatives de zinc,
de bismuth et d’antimoine.
M. Bunsen, et plus tard M. Edmond Becquerel, ont utilisé
dans la construction des piles thermo-électriques la pyrite de
cuivre. Celle que M. Edmond Becquerel imagina, en 1865, était
formée de sulfure de cuivre artificiel et de maillechort (alliage
de cuivre et de nickel).
Aucune des piles que nous venons d’examiner n’a reçu
d’application pratique. La première dont on fait usage industriellement
est celle de M. Noé, physicien de Vienne, faite avec du
maillechort et un alliage de zinc et d’antimoine.
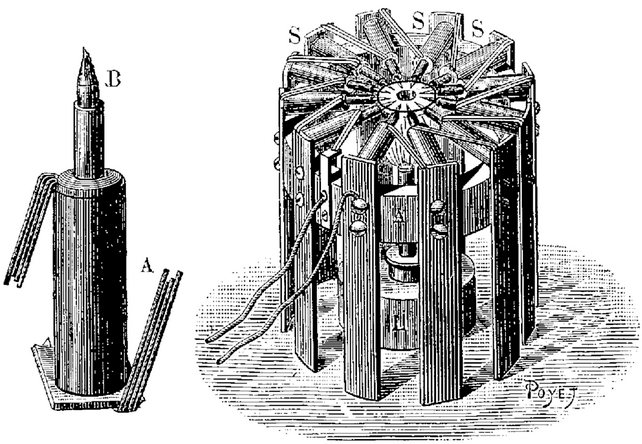 la pile thermo-électrique Noé
la pile thermo-électrique Noé
Les soudures S, S, qui par leur échauffement doivent produire
le courant électrique, sont chauffées dans un petit cylindre
de laiton A, porté sur une base métallique circulaire,
L, au centre de laquelle s’élève une tige de cuivre
rouge, B, terminée en pointe, et c’est cette pointe métallique
qui reçoit la chaleur produite par un bec de gaz dans la flamme
duquel on plonge ce petit cylindre. Une pile Noé de 25 éléments
décompose l’eau.
La pile Noé est employée en Autriche, pour les opérations
de dorure, d’argenture et de nickelage. L’appareil est d’une
assez grande durée.
Vint ensuite la pile de M. Clamond, puis celle de MM. Mure et Clamond,
et enfin, la nouvelle pile thermo-électrique que M. Clamond a
construite en 1879 .
L’appareil de M. Clamond est, de tous les générateurs
de ce genre, le plus pratique et le plus puissant. Il peut servir, soit
pour la galvanoplastie, soit pour mettre en action de petits moteurs,
soit enfin pour produire de la lumière. La pile dont M. Clamond
s’est servi pour ses expériences d’éclairage
électrique se composait de 6 000 couples, capables d’alimenter
deux régulateurs Serrin, fournissant chacun une lumière
équivalente à 50 becs Carcel. Son principal inconvénient
est de s’altérer à la longue.
Les piles thermo-électriques sont loin d’avoir dit leur dernier mot. L’idée d’allumer un calorifère pour produire un courant électrique est, en effet, de nature à exciter le zèle des inventeurs, et peut-être trouvera-t-on un jour dans ce genre d’appareil la solution du problème de la production de l’électricité à bon marché.
| LES PILES THERMO-ÉLECTRIQUES A LUMIÈRE
DE M. CLAMOND Th.
du Moncel
Les piles thermo-électriques imaginées par M. Seebeck, en 1821, n’avaient été considérées pendant longtemps que comme des générateurs d’une grande constance, susceptibles d’être employés avec beaucoup d’avantage dans les expériences scientifiques, mais incapables d’être appliqués en pratique en raison de la faiblesse du courant qu’ils produisaient; l’application que fit, il y a quelques années. M. Marcus du pouvoir thermo-électrique considérable des alliages métalliques (*) et la possibilité de les chaufter à une température élevée sans détériorer la pile, firent entrer la question des piles thermo-électriques dans une nouvelle phase, qui fut exploitée avec succès par plusieurs physiciens et en particulier par MM. Farmer, Bunsen, Ed. Becquerel, Clamond, Noé, etc. On put alors obtenir des piles dont l’intensité électrique pouvait être comparée à celle des éléments à acide, et ces piles furent même employées avec beaucoup d’avantages pour la galvanoplastie et l’électrotypie ; mais, de tous les appareils de ce genre, ceux qui donnèrent les plus grands effets furent sans contredit les piles de M. Clamond. Dès l’origine de son invention, c’est-à-dire
en 1870, M. Clamond avait prévu qu’il pourrait un
jour obtenir avec ce genre de pile de la lumière électrique
et voici ce que j’en disais dans mon Exposé des applications
de l’électricité, t. I, p. 426, publié
en 1871 : « MM. Mure et Clamond construisent en ce moment,
dans ce système, des batteries de 1500 grands éléments,
qu’ils prétendent être de la force de 50 éléments
Bunsen. Si, comme tout le fait espérer, la dépense
se produit dans les mêmes conditions que dans le cas étudié
(chauffage au coke), la dépense sera environ de 3.0 centimes
par heure, et la pile thermo-électrique pourra ainsi devenir
une source économique de lumière électrique.
» Mais disons sur quel principe repose cet ingénieux
appareil. (*). La découverte du pouvoir thermo-électrique considérable des ulliages métalliques avait été faite, dès l’origine, par .M. Seebeck, qui indique même l’alliage d’anti moine et de zinc comme un de ceux que l’on peut avantageusement employer, mais ce n’est qu’il y a une dizaine d’années que ces systèmes thermo-électriques ont été appliqués, et la combinaison qui développe la plus grande force électro-motrice est celle que M. Ed. Becquerel a indiquée et dans laquelle l’un des barreaux est composé d’antimoine et de cadmium à équivalents égaux et l’autre barreau de bismuth et d’antimoine, ce d ernier métal n’entrant que pour un dixième dans l’alliage. Pour les reche relies scientifiques cette combinaison donne les meilleurs résultats, m ais pour les applications industrielles elle ne pourrait pas être facilement employée; d’abord parce que le prix de l’appareil serait excessivement élevé, et en second lieu parce que le système ne pourrait pas être soumisà une température aussi haute que celle à laquelle peuvent être exposés les autres alliages. De sorte que la combinaison antimoine et zinc avec lames de fer adoptée par M. Clamond, quoique ne donnant pis par elle-même une force électro- motrice aussi considérable, peut fournir de meilleurs résultats par la plus grande différence des échaufFements que l’on peut lui communiquer. NOTE DE M. C. CLAMOND SUR SA NOUVELLE PILE THERMO-ÉLECTRIQUE
Présentée à l’Académie des sciences
Par M. Th. du Moncel, en séance du 5 mai 1879 Ces expériences ont été faites
sur un appareil dont la surface de chauffage est de 20 mètres
carrés, qui mesure 1 mètre de diamètre et
peut faire marcher simultanément deux lampes, système
Serrin, avec un pouvoir éclairant variant de 30 à
50 becs carcels pour chaque lampe, le foyer ayant été
soumis à différentes conditions de tirage et de
chauffage. C. Clamond. |
La Pile Chaudron
M. Chaudron a cherché à perfectionner
la pile Clamond en la modifiant par le détail plutôt que
dans son ensemble. Le couple est constitué par une lame de fer
étamé et par un bloc d’un alliage antimoine et zinc,
connu sous le nom d’alliage de Marcus.
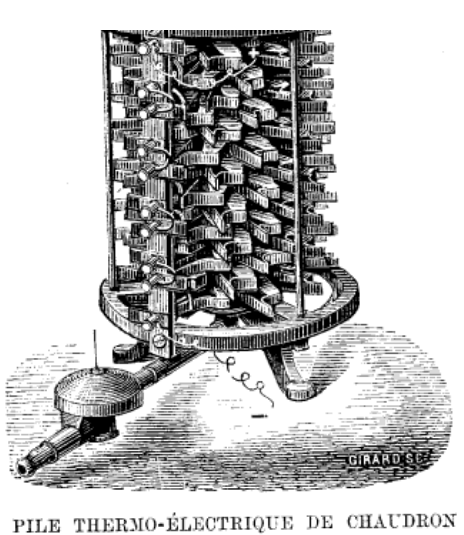

La pile se compose de couronnes superposées, comprenant chacune
10 éléments, séparées les unes des autres
par des rondelles d’amiante, absolurnent comme le faisait M. Clamond
dans son premier modèle ; l’assemblage des couronnes est
copié de même sur le type primitif. Mais, grâce sans
doute à quelques tours de main de fabrication et d’agencement,
cette pile est très constante, très durable et on a pu
la faire fonctionner plusieurs mois de suite sans la détériorer
aucunement.
D’après M. Hospitalier, 90 éléments donnent
5,5 volts, la résistance intérieure est de 1,5 ohm et
la consommation est évaluée à 200 litres de gaz
par heure.
La Pile Clamond-Carpentier
La pile Clamond, chauffée au gaz, est connue de tous nos
lecteurs : le modèle déposé a été
modifié par l’inventeur et sa construction a elle-même
été améliorée par M. Carpentier.
Le couple est formé de fer ou de nickel avec des barreaux d’un
alliage de zinc et d’antimoine ; ces deux métaux doivent
être alliés, suivant M. E. Becquerel, dans le rapport de
leurs équivalents pour donner le maximum de force électror
motrice ; c’est ce qui est fait très exactement dans la
nouvelle pile. On coule tous les éléments d’une couronne
d’un seul coup, dans des moules en terre cuite cloisonnée,
dans lesquels les lames de fer ou de nickel sont disposées à
l’avance ; le moule reste comme protection des couples et il empêche
les coups de feu, tout en permettant d’élever la température
au voisinage de la fusion de l’alliage. Ces couronnes sont montées
à emboîtement les unes sur les autres, ce qui donne le
moyen de démonter la pile avec une grande facilité. Enfin
le brûleur, en terre réfractaire, est très bien
conçu et parfaitement exécuté.
Une pile de 120 éléments donne 8 volts, sa résistance
extérieure ne dépasse pas 3 ohms et elle brûle 180
litres par heure.
sommaire
Usages de la pile dans les télécommunications.
Les piles dans lesquelles le sulfate de cuivre est employé
comme dépolarisant sont très nombreuses, et un certain
nombre sont en usage en télégraphie, sinon en France,
du moins à l’étranger. C’est ce qui nous engage
à les faire connaître.
Le point de départ des piles à sulfate de cuivre, c’est
la pile de Daniell, dont l’invention est déjà ancienne,
mais qui est encore en usage, soit par elle-même, soit par ses
nombreuses imitations ou perfectionnements.
C’est en 1836 que le physicien anglais Daniell construisit sa première
pile au sulfate de cuivre. Elle était très compliquée,
mais elle fournissait un courant parfaitement constant. Elle était
munie d’un siphon destiné à débarrasser la
pile des liquides saturés de sel, et à lui fournir, en
échange, de l’eau pure, qui maintenait constant le degré
de saturation des liquides.
Après avoir essayé successivement des diaphragmes en vessie,
en cuir et en toile, Daniell s’arrêta enfin au vase poreux
en porcelaine dégourdie.
 Pile
de Daniell.
Pile
de Daniell.
Le modèle de pile de Daniell que construit M.
Bréguet se compose d’un vase extérieur contenant
de l’eau acidulée, dans laquelle plonge une lame cylindrique
de zinc, Z.
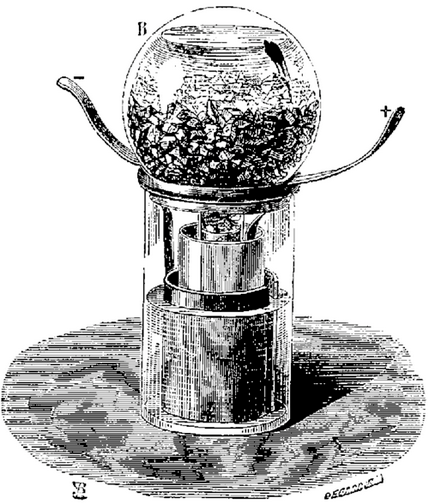
Au centre de ce vase, se trouve un vase poreux, rempli d’une solution
concentrée de sulfate de cuivre, où plonge une lame de
cuivre, C. Dans cette pile, le zinc se dissout en s’oxydant, et
forme du sulfate de zinc ; l’hydrogène produit passe à
travers le vase poreux, et réduit le sulfate de cuivre. Il se
forme donc du cuivre métallique, qui se dépose sur la
lame de cuivre et le vase poreux, et l’hydrogène se combine
avec l’oxygène, pour former de l’eau.
La disposition donnée à la pile de Daniell par M. Vérité,
horloger de Beauvais, pile que nous représentons, dispense de
tout entretien.
Un ballon B, rempli d’eau et de sulfate de cuivre, et dont le goulot
porte un bouchon, traversé par un tube de verre, plonge dans
le liquide du vase poreux. À mesure que le sulfate de cuivre
dissous se consomme, dans la pile, il est remplacé par celui
du ballon, qui maintient sans cesse la saturation du liquide dépolarisateur,
mais a l’inconvénient de réduire un peu l’intensité
du courant.
 — Pile Daniell
à auge.
— Pile Daniell
à auge.
La pile de Daniell représentée a servi pendant très
longtemps, en Angleterre, pour la télégraphie, et elle
est encore très répandue pour cet usage.
Elle se compose d’une boîte en bois de teck, divisée
en dix compartiments par une plaque d’ardoise C ; chaque compartiment
renferme deux cloisons séparées par une plaque de porcelaine
poreuse. Sur chaque ardoise on met, à cheval, une lame de cuivre,
qui supporte, d’un côté une plaque de cuivre, et de
l’autre côté une lame de zinc. Dans le dernier compartiment,
à gauche, est une plaque de cuivre, qui aboutit à un bouton
; c’est le pôle positif de la pile.
Dans les compartiments d’électrode cuivre on met la dissolution
de sulfate de cuivre avec quelques cristaux du même sel, qui maintiennent
la dissolution saturée.
L’emploi d’une caisse en bois a pour but de supprimer les
vases de verre, très exposés à être brisés
pendant un long service. Il faut seulement que la caisse soit bien étanche,
ce qui n’arrive pas toujours, et la pile est alors hors de service.
La boîte étant fermée par un couvercle de bois l’évaporation
de l’eau est très lente. Enfin le transport de l’appareil
est facile.
Cette pile que les télégraphistes anglais appellent trough
battery (pile à auge) a les dimensions suivantes : pour
le cuivre un carré de 7 centimètres de côté
; pour le zinc un rectangle de 9 centimètres sur 5. Une pile
de dix éléments coûte 26sh25 et l’entretien
revient à 10 livres par an. Elle fonctionne un mois sans que
l’on ait à ouvrir la boîte.
La pile Muirhead, très employée en Angleterre,
pour le service des lignes télégraphiques, est un perfectionnement
de la précédente.
Elle se compose d’une caisse en bois, contenant cinq vases de porcelaine,
munis de deux séparations dans lesquelles sont placés
des vases poreux plats. Le vase extérieur est carré et
en porcelaine blanche. On y place un vase poreux en terre rouge, qui
reçoit l’électrode de cuivre et le sulfate de cuivre.
À l’extérieur du vase poreux on met l’électrode
zinc. Les électrodes de cette pile sont les mêmes que ceux
de la pile de Daniell à auges, que nous venons de décrire.
La pile Muirhead a été la plus employée en Angleterre
pour la télégraphie. Au bureau central des télégraphes
du gouvernement, à Londres, il y a 20 000 éléments
semblables à ceux dont nous venons de parler.
En Italie et dans l’Inde anglaise, on emploie la pile de M.
Minotto (de Venise), dans laquelle le vase poreux est remplacé
par une couche de sable ou de sciure de bois, imprégnée
d’une dissolution de sulfate de cuivre.
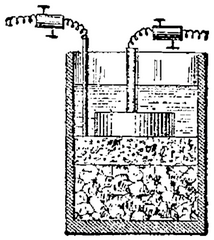
C’est une pile de Daniell à sable. Une simple
feuille de papier buvard sépare les deux liquides. Dans l’eau
acidulée plonge le pôle négatif, formé d’un
disque plat de zinc ; et au fond de la pile se trouve le pôle
positif, formé d’un disque semblable de cuivre rouge.
Cette pile est très constante, et sa résistance est d’environ
2 ohms quand elle est en bonne condition.
Les piles Minotto qu’emploient les Compagnies de câbles sous-marins
diffèrent de la précédente quant à la forme.
Elles se composent d’un vase en gutta-percha, au fond duquel est
placé un disque de cuivre, d’où part un fil isolé,
formant électrode. Cette pile a l’avantage d’être
très portative ; aussi l’emploie-t-on généralement
pour les épreuves faites à la mer ou même à
terre, sur les câbles sous-marins.
Une troisième forme de pile Minotto consiste en un vase de cuivre,
au fond duquel on dépose des cristaux de sulfate de cuivre, que
l’on recouvre ensuite de sciure de bois. C’est sur cette couche
que repose le zinc. Le montage de cette pile est des plus simples et
son fonctionnement d’une régularité parfaite. Il
suffit pour l’entretenir de l’humecter de temps à autre.
La pile Minotto est employée pour la télégraphie
dans toute l’Inde anglaise.
Sir W. Thomson a construit un élément
à sulfate de cuivre, beaucoup moins résistant et beaucoup
plus énergique que celui de Daniell. Les éléments
qui servent à faire fonctionner son siphon-recorder, c’est-à-dire
l’appareil qui enregistre les signaux du télégraphe
transatlantique, et que nous aurons à décrire dans le
Supplément au Câble transatlantique, sont formés
d’auges ayant 0m,40 carrés à la base, et évasées
au sommet. Elles sont doublées de plomb intérieurement
et contiennent des grilles en zinc s’appuyant sur des blocs en
terre cuite émaillée, comme on le voit sur la figure ci-jointe
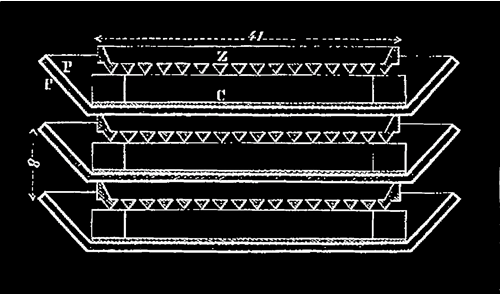
Une lame de cuivre est soudée sur le bord extérieur de
chaque auge, pour servir, au besoin, d’électrode. Afin de
faciliter l’enlèvement des dépôts de cuivre,
une lame étroite de ce métal est soudée au fond
et au milieu de chaque auge ; et tout le restant du plomb qui recouvre
l’intérieur et les côtés est enduit d’un
vernis isolant, formé de copal et de térébenthine.
Une plaque de cuivre très mince également, vernie sur
une de ses faces, excepté au centre et aux coins, fait contact,
par la pression des blocs de terre cuite et la grille en zinc, avec
le revêtement de plomb convenablement gratté dans les coins.
La face supérieure de la plaque de cuivre est décapée.
Elle est, d’ailleurs, de la même dimension que l’intérieur
des auges (0m,40 carrés). Sur ses coins on place les blocs de
terre cuite qui supportent le zinc en forme de grille.
Cet élément est enveloppé de papier-parchemin,
plié avec soin sur les côtés et fixé solidement
par de la ficelle et de la cire à cacheter. Le papier, une fois
humecté, agit comme un diaphragme, et retient homogène
l’ensemble du grillage en zinc, que le temps détériorerait.
Pour supporter une de ces pièces à auge, on construit
un bâti en bois, muni de quatre isolateurs en porcelaine, sur
lesquels vient s’appuyer la première auge.
Cette pile doit être disposée de façon à
ce que l’on puisse tourner facilement autour. La première
auge et le support doivent être soigneusement nivelés.
Au fond de la première auge, on place l’élément
cuivre, dont on assure le contact métallique au centre et aux
quatre coins ; puis on place sur ces coins les quatre blocs de terre
vernie formant de petits cubes qui servent de support au grillage en
zinc. On verse alors dans l’auge une solution de sulfate de zinc
d’une densité de 1,1 en humectant d’abord la grille
et son enveloppe en parchemin. On s’assure ensuite que les quatre
coins supérieurs du zinc et les quatre coins inférieurs
en plomb de l’auge suivante sont propres et secs, et l’on
appuie l’auge no 2 sur le zinc no 1, et ainsi de suite jusqu’à
ce que la pile soit complète.
Les cristaux de sulfate de cuivre qu’on emploie dans cette pile
doivent être en petits morceaux de la grosseur d’un pois
; on les pèse par petites quantités, d’environ 30
grammes. Pour mettre la pile en action, on verse ces 30 grammes de sulfate
de cuivre séparément, sur chaque face, distribuant cette
quantité aussi également que possible entre les blocs
de terre cuite. Immédiatement après, on met chaque élément
en court circuit, et au bout de dix minutes, la pile est prête
à agir, avec toute sa force. De temps en temps, il faut ajouter
du sulfate de cuivre, toujours par quantités égales pour
chaque auge, comme au moment où la pile a été chargée
; mais il ne faut jamais mettre de nouveau sulfate de cuivre, tant que
la quantité mise précédemment n’est pas complètement
usée. De temps à autre, il faut retirer, avec un siphon,
et à partir d’un point inférieur au niveau extrême
du sulfate de zinc, assez de liqueur pour abaisser son niveau d’environ
7 millimètres, puis rétablir ce niveau en versant de l’eau
fraîche jusqu’à ce qu’elle soit à la hauteur
des grilles de zinc.
La résistance intérieure de ces éléments
est très faible, tandis que leur force électromotrice
est considérable.
La pile Siemens & Halske 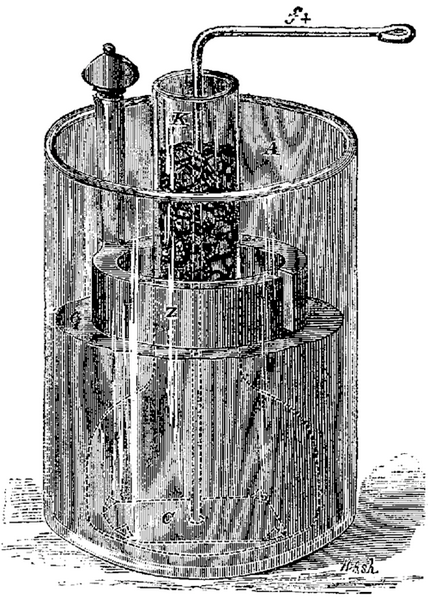
L’élément Siemens et Halske, adopté en Allemagne,
est une pile Daniell dont la cloison poreuse est plus épaisse.
Il se compose, comme on le voit, d’un vase cylindrique de verre,
au fond duquel est placée une bande de cuivre, C, en forme de
S, à laquelle est soudé un fil servant d’électrode
négative. On recouvre la bande de sulfate de cuivre, et, après
avoir placé dessus une cloche en terre poreuse, surmontée
d’un manchon en verre, K, sur lequel pose l’électrode,
on la remplit de cristaux de sulfate de cuivre.
Au-dessus de la cloche on met, après l’avoir exprimée,
une sorte de bouillie faite avec du papier et son quart en poids d’acide
sulfurique étendu de quatre fois autant d’eau. Sur cette
pâte, qui sert de vase poreux, on pose un morceau de toile, que
l’on recouvre de cristaux de sulfate de zinc, et par-dessus, un
cylindre de zinc fondu, muni d’une borne en laiton.
Pour mettre l’élément en activité, on verse
de l’eau dans le manchon de verre et sur le zinc.
Bien que la résistance intérieure de cette pile soit assez
grande, on l’emploie néanmoins avantageusement en télégraphie.
Pour éviter que le sulfate de cuivre ne traverse la pâte
de papier et ne recouvre la cloche de terre poreuse, M. Varley
a eu l’heureuse idée de remplacer la pâte de l’élément
Siemens-Halske par de la sciure de bois recouverte d’oxyde de zinc.
La Pile Trouvé, à disque de papier

Dans le modèle de pile Daniell construit par M. Trouvé
chaque élément se compose de disques plats, l’un
de cuivre, et l’autre de zinc, entre lesquels se trouve une assez
grande épaisseur de rondelles de papier buvard. La moitié
inférieure de ces rondelles est imprégnée d’une
solution saturée de sulfate de cuivre, tandis que la moitié
supérieure contient une solution de sulfate de zinc. Le tout
est maintenu par une tige d’ébonite fixée au couvercle
de la pile. Il suffit de plonger l’ensemble de ces disques pour
mettre l’élément en action.
La pile de M. Trouvé est très régulière
et d’une résistance très faible ; on l’emploie
avec avantage en télégraphie et pour actionner les appareils
électro-médicaux.
La Pile Callaud. 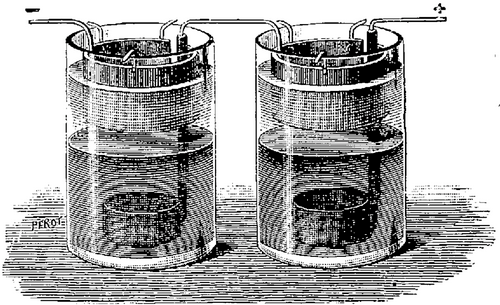
La pile Callaud, qui est d’un très grand
usage dans la télégraphie française, est encore
une modification de la pile Daniell. Elle se compose d’un vase
en verre, sur le bord duquel repose, à l’aide de trois crochets,
un cylindre de zinc. Une bande de cuivre, remplacée souvent par
un gros fil de cuivre roulé en spirale, est placée sur
le fond du vase, et terminée par un conducteur recouvert de gutta-percha.
Pour mettre la pile en action, on verse d’abord dans le vase de
l’eau pure, ou mieux une dissolution étendue de sulfate
de zinc ; puis on ajoute une dissolution de sulfate de cuivre, au moyen
d’un siphon, qui plonge jusqu’au fond du vase.
Cette pile est très économique et sa résistance
très faible ; quant à sa force électro-motrice
elle ne tombe que de 1/40 environ de sa valeur initiale, dans l’espace
de trois ou quatre mois.
Le modèle de pile Callaud, adopté aux États-Unis,
se compose d’un vase de verre, auquel est suspendue une plaque
de zinc fondu ayant la forme d’une roue d’horloge à
quatre barrettes, sans denture. Le cuivre est enroulé en spirale
et soudé à une tige de même métal, mais isolée,
qui vient aboutir au dehors. Pour mettre cette pile en action, il suffit
d’y jeter des cristaux de sulfate de cuivre et de verser par-dessus
de l’eau pure. Les deux solutions se séparent en vertu de
leur densité, et le courant apparaît presque aussitôt
après le montage.
On doit à Gaiffe une pile de Daniell,
dans laquelle la réaction du zinc sur le sulfate de cuivre reste
nulle tant que le circuit est ouvert.
L’élément se compose : d’un bocal en verre à
la partie supérieure duquel est suspendu un zinc comme dans l’élément
Callaud ; d’un vase central formé d’une partie poreuse
et d’une partie non poreuse, constituée par un verre à
boire ordinaire ; enfin d’un cylindre de cuivre, contenu dans le
vase central, et dont un prolongement recourbé en dehors de ce
vase plonge jusqu’au fond du bocal, et se termine par un anneau.
Le couple se charge à l’aide d’une solution concentrée
de sulfate de zinc.
Enfin, M. Trouvé a construit un élément
Callaud dont le prix de revient est des plus modiques.
Il est formé d’un vase de verre sur les bords duquel le
cylindre de zinc est retenu par trois courbures que l’on y pratique
avec une tenaille. L’électrode négative est constituée
par un fil de cuivre en spirale dont le bout, isolé par un tube
de verre, sert de fil de dérivation. Le fil du pôle zinc
de chaque élément vient s’enrouler sur le fil de
cuivre de l’élément suivant et rend ainsi très
facile son accouplement. La pile Callaud-Trouvé peut être
employée avec avantage dans l’installation des sonneries
d’appartements, des télégraphes et des téléphones
domestiques, mais elle a été construite surtout pour des
usages médicinaux.
L’administration badoise des télégraphes
ainsi que celle de l’Allemagne du Nord, emploient une pile au sulfate
de zinc, qui est basée, comme les précédentes,
sur la différence de densité de deux liquides. Nous voulons
parler de la pile Meidinger, dont l’usage est aujourd’hui
très répandu.

Chaque élément se compose d’un vase en verre, rétréci
vers la base, et contenant une sorte de capsule d, d, reposant sur le
fond.
Une éprouvette h, remplie de cristaux de sulfate de cuivre, et
percée, à sa partie inférieure, d’un petit
orifice, repose sur les bords de la capsule. Celle-ci contient un cylindre
de plomb g auquel est soudé un fil de cuivre isolé aboutissant
au dehors. Enfin un cylindre de zinc, Z, muni de son électrode,
vient reposer sur le rebord que forme le rétrécissement
du vase extérieur.
Pour charger l’élément, on remplit d’abord le
vase en verre d’une solution d’eau additionnée de 90
grammes de sulfate de magnésie ; on y introduit ensuite la capsule,
puis le cylindre de plomb et enfin l’éprouvette garnie de
sulfate de cuivre. Pour éviter la concentration de la solution
de sulfate de magnésie, il convient d’ajouter un peu d’eau
de temps en temps. Il est indispensable d’enduire aussi de paraffine
les bords du vase extérieur afin d’empêcher le dépôt
des cristaux de sulfate de soude.
Dans l’Allemagne du Nord, on remplace souvent l’éprouvette
par un ballon en verre rempli d’une dissolution concentrée
de sulfate de cuivre, et muni d’un bouchon au travers duquel passe
un petit tube en verre qui plonge dans la capsule.
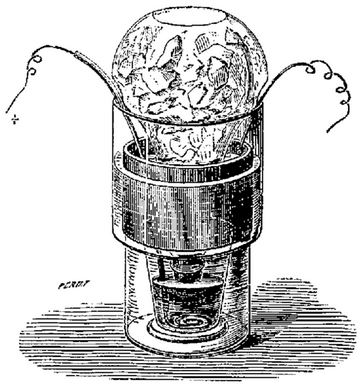 Pile
Meidinger à ballon.
Pile
Meidinger à ballon.
Cet élément, dont la résistance intérieure est très faible, et la force électromotrice relativement considérable, fonctionne plus d’une année, sans exiger le moindre entretien.
Enfin M. Reynier a perfectionné l’élément Daniell en remplaçant l’acide sulfurique par de la soude caustique. Il diminue ainsi la consommation du zinc, empêche la diffusion de la solution cuprique, lorsque la pile est au repos, et augmente dans de notables proportions la force électro-motrice qui peut atteindre jusqu’à 11 volts.
Le télégraphe électrique
Le télégraphe électrique a pu être développé
grâce à la découverte de nombreux phénomènes
scientifiques ainsi que l’invention des batteries.
En 1820, Hans Christian Oersted constate la déviation
d’une aiguille magnétique par un courant électrique.
La première démonstration d’un télégraphe
électrique en 1832 à Saint-Pétersbourg par Paul
Schilling utilise ce phénomène. Par la suite, de nombreux
autres scientifiques et inventeurs proposèrent une nouvelle version
du télégraphe électrique mais c’est le système
développé par le peintre Samuel Morse en 1837 qui est
massivement utilisé à partir de 1840. Avec l’aide
d’Alfred Vail, Samuel Morse développe
un système de télégraphe électrique qui
utilise un code spécifique portant son nom : le morse. L’émetteur
est un interrupteur alimenté par une batterie. Le récepteur
est un électroaimant qui actionne l’écriture du message.
Le télégraphe devient le moyen de communication le plus
rapide aux États-Unis et en Europe. Ses lignes sont installées
en parallèles des lignes de chemin de fer. Il joue notamment
un rôle très important lors de la guerre de Sécession
en permettant la communication rapide de messages entre plusieurs bataillons.
Le télégraphe sans fil
Le développement du télégraphe sans fil a été
d’une grande utilité pour la sécurité en mer.
C’est notamment grâce à lui que les naufragés
du Titanic ont pu être secourus en 1912. À la suite de
ce tragique événement, deux conférences internationales
rendirent obligatoire la présence d'un équipement de télégraphie
sans fil à bord de tous les navires. À partir des 1980,
avec la mise en place d’un réseau international de satellites
de télécommunications, la télégraphie sans
fil fut abandonnée.
Le téléphone
Le téléphone naît de la volonté d’améliorer
le télégraphe. En 1875, Alexander Graham
Bell travaillait sur un télégraphe en utilisant des
courants alternatifs lorsqu'il entendit la voix de son assistant à
travers un électroaimant à la suite de la soudure d’un
des contacts. Dès lors, le téléphone connait une
diffusion fulgurante. En 1878, ce sont des milliers de téléphones
qui sont installés aux États-Unis. En 1879, 27 000 téléphones
sont en service dans le monde, en 1900, 2 millions et en 2000, 1,5 milliards
téléphones de toutes sortes.
Les premiers postes téléphoniques nécessitaient
une batterie pour alimenter le microphone et l’utilisateur devait
tourner une manivelle pour faire sonner le poste de son correspondant.
Les premiers postes téléphoniques étaient connectés
deux à deux. À partir de 1878, les centraux téléphoniques
manuels permirent aux utilisateurs de communiquer avec n’importe
quel autre poste relié. En 1889, Amon Strowger
développe le premier sélecteur qui lui permet de mettre
en service le premier central téléphonique automatique.
Les télécommunications et les débuts de la
mondialisation
Le télégraphe a servi à instaurer la grandeur
et la puissance de l’empire anglais pendant le 19eme siècle.
Possédant le plus grand nombre de câbles de télégraphe,
l'Angleterre est aussi le pays où la télégraphie
sans fil fait ses débuts. Cette dernière permit l’intensification
des flux de communications avec les navires mais aussi avec les colonies
reculées non reliées par le télégraphe filaire.
C’est grâce à cette capacité d’obtenir
rapidement des informations que l’empire anglais a pu conserver
sa suprématie sur le monde durant le 19ème siècle.
L’utilisation du télégraphe et par la suite du téléphone, a aussi bénéficié à la suprématie des entreprises américaines. Etant détenteurs des brevets du téléphone et du télégraphe, des compagnies comme American Telephon ou Telagraph Company ce sont imposées comme les leaders mondiaux des communications. Avec le développement du téléphone eu Europe, leurs monopôles s’étend aux marchés européens et ces compagnies deviennent les principaux fournisseurs de matériels de communication dans le monde.
Le développement des télécommunications favorise aussi le développement des multinationales industrielles et tertiaires. Les communications entre différents pays pouvant maintenant s’effectuer en quelques heures, les entreprises commencent à installer des filiales à l’étranger pour pouvoir augmenter leur parts de marché et leurs bénéfices. Les télécommunications permettent aussi l’augmentation de la productivité des systèmes de productions. Les informations de direction, les nouvelles des marchés et les exploits commerciaux circulent beaucoup plus rapidement, les négociations de contrat sont plus rapides. Tout ceci permet une augmentation de la rapidité de prise de décision et ainsi une meilleure productivité des chaînes de production. De plus, les télécommunications contribuent à l’alignement des prix des marchés mondiaux et donc à la naissance de la notion de compétitivité. En permettant la circulation d’informations beaucoup plus rapides sur l’état des marchés, les coûts et prix de production dans différents endroits du monde, les télécommunications ont favorisé la concurrence mondiale. Par exemple, de 1870 à 1913, l’écart du prix du fer entre Philadelphie et Londres est passé de 85% à 19%. Le développement des télécommunications a permis une véritable mondialisation de l’économie. Devenue un atout indispensable pour la compétitivité des entreprises, les télécommunications ont révolutionné les modes de production et la valeur du travail. Avec les débuts de la concurrence internationale, c’est toute l’organisation de la chaîne de production qui est repensée pour satisfaire au plus les critères de compétitivité, à savoir produire une marchandise à des coûts les plus bas possibles tout en maintenant un niveau de qualité acceptable. Cette révolution, en parallèle avec les avancées technologiques, aboutira à la mécanisation des chaînes de production et à une modification des garanties sociales des employés qui aura pour conséquence de nombreuses revendications.
Les télécommunications ont également permis l’augmentation des flux financiers. En 1851, la première utilisation du câble reliant Londres à Paris fut pour communiquer les coûts de clôture de la bourse de Paris aux banquiers de Londres. Dès lors, les banques et investisseurs, informés par les états des marchés grâce au télégraphe, peuvent en quelques minutes décider d’investir dans n’importe quelle entreprise mondiale. Le télégraphe a permis l’explosion des investissements spéculatifs qui en 1900 constituaient près de 80% des flux de capitaux.
L’augmentation de ces divers flux a favorisé un développement déséquilibré des pays du monde, en favorisant les pays riches possédant les dernières technologies de communications. ...
De nombreuses variantes de piles existent : piles alcalines, piles au mercure, etc. Toutes ont cependant en commun de ne pas être rechargeables.
Suite à la création de la pile électrique,
les technologies de pile évoluent.
En effet, de nouveaux formats apparaissent, de nouveaux matériaux
également. Le progrès permet l’amélioration
permanente de la pile dans son utilisation et sa durée de vie.
La pile saline : En 1859, la première
batterie rechargeable au plomb est inventée par Gaston Planté,
un physicien français. Quelques années plus tard, la pile
« sèche » est créée, qui est à
l’origine de la pile saline, constituée de zinc et de dioxyde
de manganèse.

Les piles au mercure
L’entreprise Duracell est à l’initiative de la
création des piles au mercure. Son histoire commence dès
le début des années 1920 avec le scientifique Samuel Ruben
et un fabricant de filaments de tungstène, Philip Mallory. C'est
leur collaboration qui va leur permettre de faire avancer les choses.
Samuel Ruben a révolutionné la technologie de la pile.
En effet, pendant la Seconde Guerre Mondiale, il conçoit une
pile au mercure assez résistante pour être utilisée
dans des climats extrêmes, comme en Afrique du Nord et dans le
sud du Pacifique. De plus, il a souhaité concevoir une pile qui
possède une plus grande capacité dans un espace moindre.
Il était à ce moment-là important de trouver une
autre solution car les batteries zinc-charbon, habituellement utilisées
dans les torches électriques, les détecteurs de mines
et les talkies-walkies, ne pouvaient pas résister à d'aussi
fortes conditions. Suite à cela, Mallory a fabriqué des
millions de piles au mercure pour les armées.
Peu après, dans les années 1950, Samuel Ruben a continué
d'améliorer la pile alcaline au manganèse, en la rendant
plus compacte, et en prolongeant sa durée de vie, afin d'en faire
la plus performante de toutes les piles fabriquées jusqu’à
cette époque.
En 1991, le mercure est définitivement interdit dans les piles
bâton. Il faudra cependant attendre près de 20 ans pour
qu'enfin, depuis 2012, les fabricants n’utilisent plus de mercure
dans les piles bouton.
En effet, on s’est peu à peu rendu compte de la dangerosité
de ce métal : il peut causer de graves problèmes de santé
(effets toxiques sur les systèmes nerveux, digestif et immunitaire,
et sur les poumons, les reins, la peau et les yeux). Le mercure est
considéré par l’OMS comme l’un des dix produits
chimiques ou groupes de produits chimiques extrêmement préoccupants
pour la santé publique.
La pile alcaline :
Milieu des années 60 Union Carbide (Karl Kordesch), États-Unis
Développement de la pile alcaline primaire.
Plus performante et plus petite, elle est utilisée dans de nombreux
appareils de la vie domestique comme les lampes électriques,
les talkies-walkies des militaires ou encore les détecteurs de
mines.
Cette pile rencontre un véritable succès car elle est
beaucoup plus performante que la pile saline.
Les piles alcalines, comme sont appelées les piles primaires
zinc-chimie, sont les plus utilisées dans le monde, ce qui représente
un bond de 70 pour cent du marché des piles en 2011 avec 10 milliards
d’unités individuelles produites dans le monde et le marché
de ces piles devrait augmenter d’un montant de 5,4 milliards de
dollars rien qu’aux États-Unis en 2015.
Des cellules primaires qui utilisent une solution alcaline plutôt
que des acides pour leur solution d’électrolyte ont existé
depuis le début du 20e siècle grâce aux découvertes
de Waldemar Jungner et Thomas Edison. Cependant, c’est l’ingénieur
canadien Lewis Urry qui a inventé la pile alcaline Zinc/Manganèse
qui est omniprésente actuellement .
La pile au lithium : Au début des années
1970, après de multiples recherches, la pile au lithium est inventée.
Les piles Alcalines devancées par une autre forme de la chimie
de la pile, la Lithium non rechargeable. Ces piles sont faites avec
des anodes de lithium ou du disulfure de lithium-fer et une cathode
de dioxyde de manganèse en suspension dans une pâte d’électrolyte
de sel de lithium dissous. Elles sont aussi connu sous le nom de lithium
« en tension compatible», puisque ce type de pile peut produire
des tensions de production de la charge de 1,5 V AA ou alcalines AAA
jusqu’à 3.7v, mais malheureusement, ces piles utilisent
une forme métallique de lithium pour leurs électrodes
qui empêche leur recharge. Vous pouvez les trouver en vente sous
des noms de marque comme lithium Energizer et Rayovac lithium photo.
Elles ont le double de durée de vie que les piles alcalines dans
les appareils à forte consommation, grâce à leur
plus grande capacité et faible résistance interne et n’ont
pratiquement aucune autodécharge, ce qui leurs permet d’avoir
une durée de vie de 10 ans. Elles sont toutefois plus chères
que des piles alcalines classiques et ne peuvent pas être rechargées
comme les cellules NiMH.
Les piles au lithium, ainsi que d’autres dispositifs comme les
batteries se développèrent de plus en plus dans les années
80-90.
Milieu des années 70 Développement de
la batterie acide-plomb à valve régulée.

Les piles rechargeables
Le développement des appareils de photo numérique,
des lecteurs de musique MP3, des téléphones et des ordinateurs
portables s'accompagne d'un essor des « piles » rechargeables,
qui sont en fait des accumulateurs (ou batteries) miniaturisés,
dont il existe différents types : nickel-cadmium, nickel-métal-hydrure,
lithium-ion, lithium-polymère.
1990 La batteries au NiMH
La recherche sur les batteries au NiMH commença dans les années
1970 mais les alliages d'hydrures métalliques étaient
instables dans le contexte d'un accumulateur. Des nouveaux alliages
d'hydrures furent développés dans les années 1980
qui améliorèrent leur stabilité. Le NiMH devint
disponible commercialement dans les années 1990.

1992 Karl Kordesch, 1922 , Canada Commercialisation de la pile
alcaline réutilisable.
1999 Commercialisation de la pile Li-ion polymère.

2002 Production limitée d'une pile à combustible
avec membrane à échange de protons (PEM)
Dans son principe, la pile à combustible repose sur la réaction
inverse de l'électrolyse de l'eau (décomposition en hydrogène
et oxygène par un courant électrique) : l'oxydation de
l'hydrogène produit de l'eau et de l'électricité.
Le principe de ce type particulier de pile électrique a été
découvert en 1802 par le Britannique Humphry Davy et c'est son
compatriote William Robert Grove (1811-1896) qui a construit, en 1839,
la première cellule combinant l'hydrogène et l'oxygène.
Les premières piles à combustible opérationnelles
ont été réalisées au milieu du xxe s. aux
États-Unis, et ont été utilisées comme générateurs
électriques pour les vaisseaux spatiaux habités américains
(programmes Gemini et Apollo). Elles ont connu ensuite d'autres applications,
notamment dans le domaine militaire.
Perspectives
Aujourd'hui, avec l'attention portée à la protection de
l'environnement et les craintes suscitées par l'appauvrissement
progressif des ressources énergétiques fossiles, la pile
à combustible fait l'objet d'intenses recherches. Non polluante
(pas de rejets de gaz à effet de serre), silencieuse et d'un
excellent rendement énergétique, elle présente
d'importants atouts pour contribuer, dans le futur, à la production
d'énergie (électricité et chaleur) et à
la propulsion des véhicules automobiles. Cependant, c'est un
dispositif qui reste pour l'instant très coûteux.
L'un des modèles de pile à combustible les plus étudiés aujourd'hui est la pile à membrane échangeuse de protons. Elle comprend deux électrodes minces et poreuses séparées par une membrane de polymère qui ne laisse passer que les protons. Des catalyseurs recouvrent une face de chaque électrode. Quand l'hydrogène entre dans le dispositif, il est décomposé en électrons et en protons par le catalyseur qui recouvre l'anode. Les électrons circulent dans un circuit externe et actionnent un moteur électrique, tandis que les protons migrent à travers la membrane jusqu'à la cathode. Le catalyseur qui recouvre la cathode combine les protons avec les électrons qui, avec l'oxygène de l'air, forment de l'eau.
Le rôle de la publicité
Duracell
Pourtant, malgré son caractère discret, la pile reste
un objet de marketing : face à la concurrence, les marques de
piles et batteries se doivent d’être créatives, afin
de se démarquer auprès de la clientèle. C’est
le cas par exemple de la marque Duracell qui a créé une
mascotte, devenue emblème de la marque : le lapin Duracell. Ce
lapin rose apparaît pour la première fois en 1973 dans
une publicité Duracell, où l’on voit des dizaines
de jouets lapins jouer du tambour et tomber progressivement en panne
sauf un : le lapin alimenté par une pile alcaline Duracell. Avec
le succès de cette pub, le lapin devient alors l’emblème
de la marque. Il est en effet difficile de susciter une émotion
chez le consommateur avec uniquement une pile électrique, alors
qu’un lapin peut évoquer l’enfance, la douceur et peut
prendre vie. Il existe ainsi une multitude de publicité dans
lesquelles le lapin Duracell excelle par sa force et son endurance dans
tous les sports. C’est donc à travers le lapin que Duracell
affirme que ses piles électriques durent le plus longtemps. Afin
de se renouveler, la marque a créé diverses campagnes
publicitaires telles que « Some toys never die », inspiré
de films d’horreurs tels que Annabelle. Il s’agit de mises
en scène angoissantes où l’on voit des enfants se
faire hanter par leurs anciens jouets alors qu’ils jouent avec
des nouveaux jouets. Ces caricatures humoristiques montrent que les
jouets alimentés pas des piles Duracell ne « meurent jamais
». Afin de réaliser ces publicités, la marque a
collaboré avec Grey, une agence spécialisée dans
la production de publicités originales. Chaque détail
est donc réfléchi pour mettre en valeur les piles Duracell
et marquer l’esprit du consommateur. Par exemple, la lumière
éclaire uniquement les anciens jouets afin de les rendre plus
menaçants.
Energizer
Le succès du lapin Duracell est tel qu’il attire la convoitise
des autres marques. Ainsi, en 1989, l’entreprise Energizer profite
d’un oubli de renouvellement des droits d’utilisation du «
lapin rose » pour créer son propre lapin et d’en faire
sa mascotte. La première publicité d’Energizer est
une reprise de celle de Duracell, mais cette fois-ci le lapin d’Energizer
s’invite à la « compétition de durabilité
» et dépasse les autres. La marque rivale de Duracell tente
de se différencier de cette dernière avec un lapin ayant
une attitude plus « cool » et désinvolte. Symbole
de la rivalité entre les deux marques : le méchant «
Supervolt » inventé par Energizer qui tentera par tous
les moyens de détruire le lapin Energizer, sans succès,
et qui est une allusion au lapin concurrent, Duracell. Si le lapin Energizer
s’est affirmé aux États-Unis, c’est celui de
Duracell qui est resté plus célèbre en Europe
les piles et les batteries nous amènent-elles à un changement de paradigme ?
Leur invention eut un fort impact dans nos vies, et ce dès le XXème siècle. Elles ont un objectif commun : faciliter la vie de l’Homme en miniaturisant le stockage d’énergie, mais elles restent la partie cachée de l’iceberg, l’objet final étant la partie visible. Grâce à la pile, nous gagnons en autonomie et il est aujourd’hui possible et très courant de se déplacer avec de l’énergie sur soi-même, et ce n’importe quel soit le lieu. Cela contribue fortement à notre liberté. Nous allons nous appuyer sur des exemples majoritairement récents, c'est-à-dire développés dans notre siècle à nous.
Actuellement, il est possible de sortir de chez soi
tout en continuant ses activités si l’on en avait entamé
(écouter de la musique, poursuivre un appel téléphonique,
etc.). Les batteries qui sont à l’origine de nombreux produits
high-tech récents tels que les téléphones, tablettes
ou encore ordinateurs, permettent de maintenir le contact pendant les
vacances par exemple, que ce soit avec les proches ou bien dans un cadre
professionnel. Dans un monde qui bouge de plus en plus, il est de nos
jours quasiment primordial de pouvoir communiquer avec ses collègues,
clients, professeurs, et ce même si l’on se trouve sur une
plage à l’autre bout du monde. Il y a d’ailleurs plusieurs
métiers qui auraient beaucoup de mal aujourd’hui sans indépendance
énergétique, majoritairement sans les téléphones
portables. Comment faire pour communiquer si l’on ne travaille
pas dans une endroit fixe ? En effet, les gens travaillant à
domicile par exemple (infirmiers(ères), hommes/femmes de ménages…)
ont besoin d’échanger avec leurs clients, pour confirmer
ou annuler un rendez-vous à la dernière minute par exemple.
Ainsi l’Homme s’est créé une réelle dépendance
face à ces nouveaux objets. Il est en effet facile de l’observer
lorsque l'on se balade dans la rue : les gens regardent leurs pieds,
ou plutôt leur téléphone ou montre connectée
pour prendre des photos, chatter sur les réseaux sociaux, etc.
Dans plusieurs pays comme dans le Royaume-Uni, les trottoirs ont depuis
été adaptés puisque de simples marquages au sol
permettent maintenant de voir si l’on arrive à une intersection
(passage piéton) ou non. Aux Pays-Bas, la ville de Bodegraven
teste actuellement un nouveau dispositif : une ligne de LED à
l’arrivée de chaque passage piéton.
Groupe de jeunes sur leur smartphone
Le traitement de l’information a pris un tournant inédit. En seulement quelques minutes, une actualité venant d’un coin de la Terre peut être relayée dans le monde entier. Les smartphones, avec l’arrivée des réseaux sociaux et nouveaux moyens de communication, permettent de garder un lien constant sur l’information en temps réel.
Ces innovations ont bien changé les mentalités et habitudes humaines. En plus d’un réel gain de temps et de liberté, la fainéantise est l’une des autres conséquences sur notre comportement. La pile qui se trouve dans toutes nos smartphones, télécommandes, manettes de jeu, produits ménagers (…), ne facilite en ce sens pas notre activité au sein du foyer. On a donc un Homme qui devient de plus en plus dépendant de la nouvelle technologie, et ce sur différents points. Tout ceci n’était évidemment pas encore le cas quelques décennies auparavant, ce qui prouve bien qu’il y a eu un changement.
Cette transition s’accompagne d’autres innovations issues du même principe de stockage d’énergie, mais qui peuvent nécessiter un peu plus de temps pour être réellement adoptées par tous. C’est le cas des voitures électriques. Les gens, attachés aux voitures à moteur thermique, réalisent petit à petit leur impact, et se tournent pour cela de plus en plus vers des solutions éco-responsables. Toutefois, ces changements d’habitudes entraînent de nouveaux réaménagements, tout comme dans les parkings et dans certaines rues avec l’installation de prises pour les véhicules électriques.
De manière analogue, on peut observer l’installation de plus en plus fréquente de prises électriques dans les gares et aéroports par exemple, notamment dans les salles d’attente, dans le but de permettre aux clients de recharger leurs appareils électroniques à n’importe quel moment de la journée. Ainsi, on peut voir que ces nouveaux produits high-tech nous impactent non seulement nous, mais aussi notre environnement : il s’agit de repenser et remoderniser nos infrastructures.
Il ne faut pas oublier que tous ces changements proviennent de mêmes innovations : celles des piles et batteries. Selon la définition donnée par Universalis, nous pouvons donc bel et bien parler d’un « changement de paradigme »
Juste pour savoir : La première voituire électrique
|
C'est en 1834 qu'un américain, Thomas Davenpoort,
appliqua à la traction la réversibilité des
machines magnéto-électriques, en l'utilisant an
déplacement d'une voiture circulant sur rails. Après
les essais de Jacobi sur la Neva, — essais faits uniquement
en vue de la navigation — après ceux de Davidson,
en 1838, sur les chemins de fer, et après les tentatives
d'autres chercheurs, qui eurent tous d'abord pour objectif la
traction sur voie ferrée, il faut arriver jusqu'en 1881,
époque à laquelle l'accumulateur, qui jusqu'à
présent est l'âme de la voiture électrique,
fut rendu pratique, pour voir trace des premiers véhicules
ayant véritablement fonctionné sur rails et sur
routes. Les premiers concours ont lieu dans les années
1890. La voiture électrique y fait d’abord pâle
figure, les accumulateurs ayant une trop faible densité
énergétique. Même si Charles Jeantaud s’inscrit
en 1895 à la première véritable course automobile
Paris-Bordeaux-Paris, il est obligé de concourir en construisant
une voiture de plus de 2 tonnes et de jalonner le parcours de
15 ensembles d’accumulateurs de 850 kg, chacun préalablement
chargé, qu’il compte échanger lors de son passage.
Il devra malheureusement abandonner la course à Orléans
suite à une avarie d’essieu, même s’il
finit ensuite par rejoindre Bordeaux (avant de rentrer en train). |
La pile à Hydrogène
Une pile à combustible, ou PAC, est un générateur
énergétique. Appliquée au domaine de la mobilité,
elle permet de transformer l’hydrogène en électricité
pour animer une voiture, un bus ou un camion.
Le principe de la pile à combustible a été découvert
en 1839 par le chercheur d'origine germanique Christian Schönbein.
Il a ensuite été concrétisé sous la forme
d'un prototype par Sir William Grove quelques années plus tard.
À la fin du 19ème siècle, le générateur
prend sa forme actuelle et il faut attendre les années 30 pour
que Francis Thomas Bacon relance des recherches sur la pile à
combustible.
L'ingénieur britannique met au point un premier prototype de
1 kilowatt en 1953, puis un second de 5 kilowatts en 1959. Son invention
sert par la suite de modèle pour concevoir les piles à
combustible utilisées dans le cadre des missions spatiales Apollo
de 1961 à 1972.
Trop onéreuse, cette technologie demeure réservée
durant de nombreuses années à des marchés de niche.
Il faudra attendre les années 90, et l'émergence de divers
problèmes écologiques, pour que les industriels s'intéressent
enfin aux piles à combustible.
En 2025 dénombre six grands types de piles à
combustible :
AFC (Alcaline Fuel Cells) : ces piles alcalines fonctionnent à
une température très limitée comprise entre 65
et 90 degrés Celsius. Utilisées dans le cadre des missions
Apollo, elles offrent un rendement de 50 %.
PEMFC (Proton Exchange Membrane Fuel Cells) : ces piles à membranes
échangeuses de protons bénéficient d'un démarrage
rapide et puissant. Fonctionnant à faible température
(entre 20 et 100 degrés Celsius), elles servent généralement
à alimenter des véhicules ou des installations de petites
dimensions.
DMFC (Direct Methanol Fuel Cell) : ces piles sont alimentées
par du méthanol. Celui-ci est injecté sur leur anode grâce
à de l’eau. Son oxydation suite à la catalyse génère
des ions H+, ainsi que du gaz carbonique.
PAFC (Phosphoric Acid Fuel Cells) : issues d'une technologie récente,
ces piles à acide phosphorique peuvent fonctionner jusqu'à
210 degrés Celsius. La chaleur très importante qu'elles
produisent permet de les utiliser pour une cogénération.
Elles alimentent majoritairement des structures stationnaires dotées
d'une puissance de plusieurs dizaines de mégawatts.
MCFC (Molten Carbonate Fuel Cells) : ces piles à carbonates de
potassium et de lithium fondus fonctionnent à des températures
supérieures comprises entre 600 et 700 degrés Celsius.
Leur rendement va de 60 à 80 %. Elles servent à alimenter
d'importantes installations énergétiques stationnaires.
SOFC (Solid Oxyde Fuel Cells) : ces piles à oxydes solides fonctionnent
à une température encore plus forte que la catégorie
précédente (entre 800 et 1000 degrés Celsius).
Démarrant lentement et nécessitant des composants pouvant
résister à des températures très élevées,
elles permettent de générer de l'électricité
stationnaire.
Les domaines d'application des piles à combustible
sont très diversifiés. Au niveau de la mobilité,
elles servent, par exemple, à propulser des voitures, ainsi que
des bus et des navires.
Comme nous l'avons vu plus haut, les piles à combustible peuvent
également servir à la génération stationnaire
d'électricité ou à la cogénération
de chaleur et d'électricité. Elles équipent enfin
les sous-marins et les satellites.
Chacun de ces usages nécessite une puissance, une température
et un combustible (hydrogène, oxygène, méthanol…)
distincts et qui correspondent à un type spécifique de
pile.
Fonctionnant à faible température, les AFC, PEMFC et DMFC
produisent au maximum quelques dizaines de kW. On les utilise donc généralement
pour alimenter des véhicules ou des appareils mobiles. Les PAFC
fonctionnent quant à eux à moyenne température.
Leur puissance va de 50 à 200 kW. Étant modulables, elles
peuvent servir de générateurs de secours stationnaires
de 10 mégawatts. Les MCFC et SOFC fonctionnent à température
très élevée et délivrent une grande puissance.
Elles servent notamment à alimenter en chaleur et en électricité
des habitations ou des structures industrielles...
En France, la première pile à combustible
"marine" fonctionnant à l'hydrogène a été
installée à bord d'Energy Observer courant 2017, pour
une première série d'escales en France puis en Europe
qui a conduit le premier navire autonome jusqu'au cercle arctique en
2019. Au cours de ce premier périple, Energy Observer était
doté d'une pile à combustible conçue en collaboration
avec le CEA, qui développe une puissance de 30 kW. Bien qu'elle
soit toujours à bord et ait rempli son rôle à merveille
pendant ces deux premières années, les besoins énergétiques
du navire sont allés en grandissant, à mesure que de nouvelles
technologies étaient installées pour y être testées
et que les périodes de navigation augmentaient.
C'est ce constat, combiné aux opportunités offertes par
les capacités de nouvelles piles Toyota, plus puissantes, plus
légères et plus compactes, qui ont conduit l'équipe
d'Energy Observer à proposer au constructeur japonais de se prendre
au jeu de l'autonomie énergétique en mer. En travaillant
avec les ingénieurs d'EODev, filiale industrielle d'Energy Observer,
ils ont ainsi pu donner naissance au REXH 2 , (Range EXtender
Hydrogène), dont le but est d'augmenter l'autonomie énergétique
d'un navire, que son utilisation soit destinée à la propulsion,
aux systèmes de bord ou au deux.
Le premier REXH 2, en version expérimentale, a passé de
long mois sur les bancs d'essai de Toyota en Belgique, avant de pouvoir
être enfin installé à bordd'Energy Observer.
Développant jusqu’à 150 kW de puissance
et prévue pour 2027, la nouvelle pile à combustible de
Honda est à la fois plus compacte et moins chère que la
génération actuelle.

Si la filière hydrogène connait une période difficile, les acteurs continuent de se mobiliser pour porter de nouvelles innovations. C'est notamment le cas dans le domaine des piles à combustible. Alors que Toyota a récemment annoncé l’arrivée de sa pile de troisième génération, Honda vient de révéler à l’occasion du salon H2 & FC EXPO à Tokyo les caractéristiques détaillées de la prochaine génération de sa pile à hydrogène.
La nouvelle pile à combustible de Honda affiche
une puissance de 150 kW, contre 92,2 kW pour l’actuel système
utilisé à bord du Honda CR-V hydrogène. Toutefois,
les avancées les plus marquantes sont ailleurs. En effet, la
firme japonaise annonce une réduction de moitié des coûts
de production et une durée de vie plus que doublée par
rapport à la génération actuelle.
Contrairement à la transition entre la première génération
de 2016 (Honda Clarity) et le modèle actuel, où seuls
les coûts et la longévité avaient été
optimisés, la nouvelle pile bénéficie cette fois
d’un bond technologique majeur en termes de compacité et
d’efficacité. Le module mesure 730 x 580 x 700 mm, pour
un volume total de 300 litres et un poids de 250 kg. Il affiche une
densité énergétique volumétrique de 0,5
kW/l et 0,6 kW/kg.






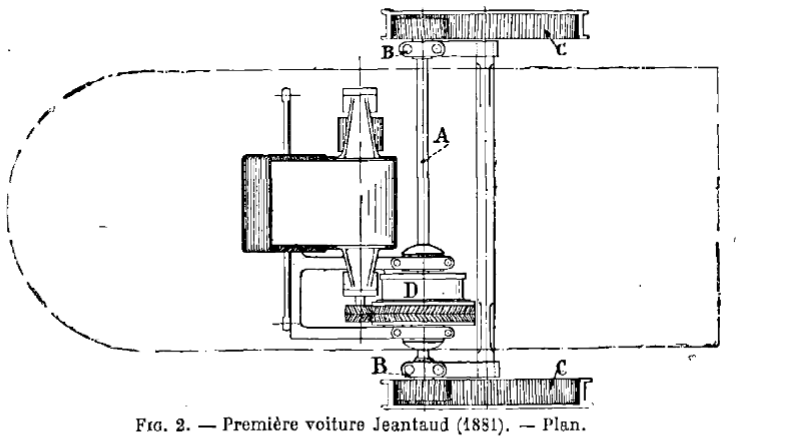

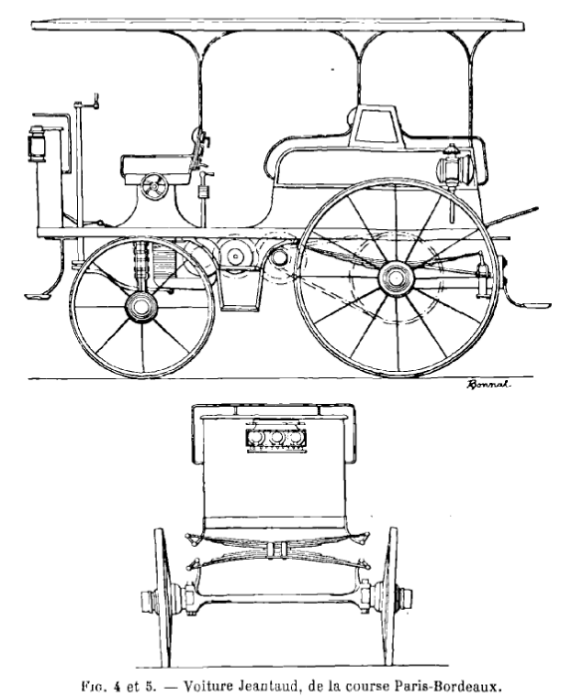



 La
Duc
La
Duc